摘要:13.某反应体系中的物质有:NaOH.Au2O3.Na2S4O6.Na2S2O3.Au2O.H2O. (1)请将Au2O3之外的反应物与生成物分别填入以下空格内. + + ―→ + + (2)反应中.被还原的元素是 .还原剂是 . (3)将氧化剂与还原剂填入下列空格中.并标出电子转移的方向和数目. (4)纺织工业中常用氯气作漂白剂.Na2S2O3可作为漂白后布匹的“脱氯剂 .Na2S2O3和Cl2反应的产物是H2SO4.NaCl和HCl.则还原剂与氧化剂物质的量之比为 . [解析] Au2O3转化为Au2O时.Au元素的化合价降低.说明在反应中Au2O3是氧化剂.在Na2S4O6中硫元素的平均化合价为+2.5价.Na2S2O3中硫元素的平均化合价为+2价.所以Na2S2O3应是还原剂.Na2S4O6是氧化产物.在(4)中1 mol Na2S2O3转化为H2SO4时失去8 mol e-.而1 mol Cl2转化为Cl-时得到2 mol e-.所以还原剂与氧化剂物质的量之比为1∶4. [答案] (1)Na2S2O3 H2O Na2S4O6 Au2O NaOH (2) Na2S2O3 1∶4
网址:http://m.1010jiajiao.com/timu3_id_88797[举报]
某反应体系中的物质有KMnO4、FeSO4、H2SO4、Fe2(SO4)3、MnSO4、K2SO4、H2O
(1)请将除水之外的反应物、产物填入以下横线中
(2)反应中,被氧化的元素是
(3)将氧化剂和还原剂填入空格中,并标出电子转移的方向和数目

查看习题详情和答案>>
(1)请将除水之外的反应物、产物填入以下横线中
MnSO4
MnSO4
+FeSO4
FeSO4
+H2SO4
H2SO4
------MnSO4
MnSO4
+Fe2(SO4)3
Fe2(SO4)3
+K2SO4
K2SO4
+H2O(2)反应中,被氧化的元素是
铁
铁
,氧化剂是KMnO4
KMnO4
,还原产物是MnSO4
MnSO4
(3)将氧化剂和还原剂填入空格中,并标出电子转移的方向和数目

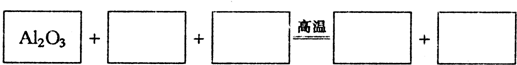
(2008?上海)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O.
(1)请将Au2O3之外的反应物与生成物分别填入以下空格并配平.
+
(2)反应中1mol还原剂
(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂和氧化剂物质的量之比为
查看习题详情和答案>>
(1)请将Au2O3之外的反应物与生成物分别填入以下空格并配平.
+
4Na2S2O3
4Na2S2O3
+2H2O
2H2O
=Au2O
Au2O
+2Na2S4O6
2Na2S4O6
+4NaOH
4NaOH
(2)反应中1mol还原剂
失去
失去
(填“得到”或“失去”)1
1
mol电子.(3)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂和氧化剂物质的量之比为
1:4
1:4
.