网址:http://m.1010jiajiao.com/timu3_id_88595[举报]
 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料.(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3.NH4AlO(OH)HCO3热分解的化学反应方程式
 Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑ Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑(2)NH4Al(SO4)2?12H2O的相对分子质量为453.欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2?12H2O固体
②将上述固体置于烧杯中
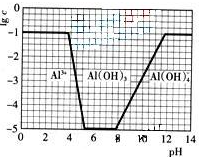
(3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有
②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注.
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为_________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体______________________g;
②将上述固体置于烧杯中,_________________________。
(3)在0.1 mol·L-1 NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:

①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有___________。
②请在答题卡的框图中,画出0.01 mol·L-1 NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要标注。
查看习题详情和答案>>![]()
![]() 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。
![]() (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
![]() (2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
![]() ①用托盘天平称量NH4Al(SO4)2·12H2O固体 g;
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g;
![]() ②将上述固体置于烧杯中 。
②将上述固体置于烧杯中 。
![]() (3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
![]()

![]() ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
![]() ②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
![]() 超细氧化铝是一种重要的功能陶瓷原料。
超细氧化铝是一种重要的功能陶瓷原料。
![]() (1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
![]() (2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
(2)NH4Al(SO4)2?12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
![]() ①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
①用托盘天平称量NH4Al(SO4)2?12H2O固体 g;
![]() ②将上述固体置于烧杯中 。
②将上述固体置于烧杯中 。
![]() (3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
(3)在0.1mol?L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
![]()
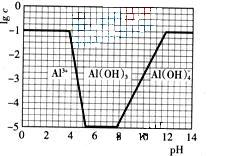
![]() ①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
![]() ②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
②请在答题卡的框图中,画出0.01mol?L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
![]()
(11分)
超细氧化铝是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式 。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100mLPH为2、浓度约为0.1mol-1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体 g;
②将上述固体置于烧杯中 。
(3)在0.1mol·L-1NH4Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液PH变化的关系见下图
①用NaOH溶液调节(2)中溶液PH至7,该过程中发生反应的离子方程式有 。
②请在答题卡的框图中,画出0.01mol·L-1NH4Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液PH变化的关系图,并进行必要的标注。
查看习题详情和答案>>