摘要:6.(09全国卷Ⅱ11) 已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1 CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1 现有H2与CH4的混合气体112L.使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ.则原混合气体中H2与CH4的物质的量之比是 A.1∶1 B.1∶3 C.1∶4 D.2∶3 答案:B 解析: 设H2.CH4的物质的量分别为x.ymol.则x + y =5.571.6x/2 + 890y = 3695,解得x=1.25mol; y=3.75mol.两者比为1:3.故选B项. 7. 1 mol HO 与足量的NaOH 溶液充分反应.消耗的NaOH的物质的量为 A.5 mol B.4 mol C.3 mol D.2 mol 答案:A 解析: 该有机物含有酚.还有两个酯基.要注意该有机物的酯基与NaOH水解时.生成羧酸钠.此外生成的酚还要继续消耗NaOH.故需要5molNaOH.A项正确. 8.(09全国卷Ⅱ13) 含有a mol FeBr2的溶液中.通入x mol Cl2.下列各项为通Cl2过程中.溶液内发生反应的离子方程式.其中不正确的是 A.x=0.4a.2Fe2++Cl2=2Fe3++2Cl- B.x=0.6a.2Br-+ Cl2=Br2+2Cl- C.x=a.2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- D.x=1.5a.2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- 答案:B 解析: 由于Fe2+的还原性强于Br-.故根据氧化还原反应的先后顺序知.Cl2先氧化Fe2+,然后再氧化Br-.2Fe2+ + Cl2 2Fe3+ + 2Cl-,2Br- + Cl2 Br2 + 2Cl-.2FeBr2 + 3Cl2 2FeCl3 + 2Br2 .当x/a ≤0.5时.Cl2仅氧化Fe2+.故A项正确.当x/a ≥1.5时,Fe2+和Br-合部被氧化.D项正确,当介于两者之间时.则要分步书写方程式.然后进行叠加得总反应.如B项.当x=0.5a时.Cl2刚好把Fe2+全部氧化.而当x=0.6a.显然Cl2还要氧化Br-.而选项中没有表示.故错.
网址:http://m.1010jiajiao.com/timu3_id_88334[举报]
下列说法正确的是( )
| A、同温同压下,H2 (g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | B、任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | C、已知:①2H2(g)+O2(g)=2H2O(g)△H=-a kJ?mol-1,②2H2(g)+O2 (g)=2H2O(1)△H=-b kJ?mol-1,则a>b | D、已知:①C(s,石墨)+O2 (g)=CO2(g)△H=-393.5kJ?mol-1,②C(s,金刚石)+O2(g)=CO2 (g)△H=-395.0 kJ?mol-1, 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ?mol-1 |
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.
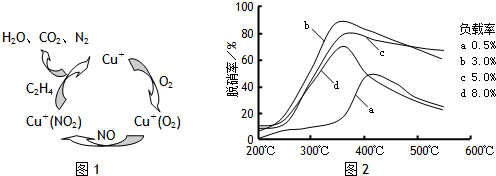
①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
查看习题详情和答案>>
(1)选择性催化还原法的脱硝原理为:6NOx+4xNH3
| ||
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
-724.5kJ?mol-1
-724.5kJ?mol-1
.(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示.

①写出该脱硝原理总反应的化学方程式:
6NO+3O2+2C2H4
3N2+4CO2+4H2O
| ||
6NO+3O2+2C2H4
3N2+4CO2+4H2O
.
| ||
②为达到最佳脱硝效果,应采取的条件是
350℃、负载率3%
350℃、负载率3%
.(1)5.7g汽油(主要成分为C8H18,相对分子质量为114)完全燃烧生成液态水和CO2,放出275.9KJ的热量,则汽油的燃烧热为
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol;H2O(l)=H2O(g)△H=+44KJ/mol
a)写出H2与O2反应生成液态水时的热化学方程式
b)在通常情况下,若要得到857.4KJ的热量,需H2的质量为
查看习题详情和答案>>
C8H18(l)+
O2(g)→8CO2(g)+9H2O(l)△H=-5518KJ/mol;
| 25 |
| 2 |
C8H18(l)+
O2(g)→8CO2(g)+9H2O(l)△H=-5518KJ/mol;
| 25 |
| 2 |
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol;H2O(l)=H2O(g)△H=+44KJ/mol
a)写出H2与O2反应生成液态水时的热化学方程式
2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol
b)在通常情况下,若要得到857.4KJ的热量,需H2的质量为
6g
6g
,这些H2在标况下的体积为67.2L
67.2L
.(2013?乐山二模)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量
(2)容器①中反应达平衡时,CO的转化率为
(3)计算容器②中反应的平衡常数K=
(4)下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=
mol/(L?min)
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)
查看习题详情和答案>>
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
小于
小于
(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.(2)容器①中反应达平衡时,CO的转化率为
80
80
%.(3)计算容器②中反应的平衡常数K=
1
1
.(4)下列叙述正确的是
a
a
(填字母序号).a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=
| 4 |
| Vt1 |
(5)已知:2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol
.(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6mol.若用200mL 5mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)
3CO2+5OH-═2CO32-+HCO3-+2H2O
3CO2+5OH-═2CO32-+HCO3-+2H2O
.