摘要:16.某化学科研小组研究在其他条件不变时.改变某一条件对化学平衡的影响.得到如下变化规律(图中p表示压强.T表示温度.n表示物质的量): 根据以上规律判断.下列结论正确的是 ( ) A.反应Ⅰ:ΔH>0.p2>p1 B.反应Ⅱ:ΔH<0.T1>T2 C.反应Ⅲ:ΔH>0.T2>T1或ΔH<0.T2<T1 D.反应Ⅳ:ΔH<0.T2>T1 [解析] 反应Ⅰ的特点是正反应方向为气体减少的方向.结合图象.压强增大A的转化率应增大.所以p2>p1.随着T的升高A的转化率降低.所以正反应为放热反应ΔH<0.故A错,关于反应Ⅱ由图象可以看出T2条件下达到平衡所用时间少.所以T2>T1.故B错,关于反应Ⅲ.由图象可以看出.T2条件下C平衡体积分数大.当T2>T1时.正反应为吸热.ΔH>0.而当T2<T1时.正反应为放热.ΔH<0故C对,关于反应Ⅳ.由图象可以看出T2时.A的转化率大.当T2>T1时.说明升高T平衡向正反应方向进行.因此正反应为吸热反应.ΔH>0.故D错. [答案] C 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_88184[举报]
 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
查看习题详情和答案>>
 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
查看习题详情和答案>>
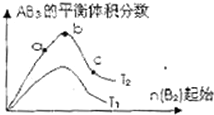 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是( )| A、达到平衡时A2的转化率大小为:b>a | B、a、b、c三点的平衡常数相同 | C、若T2>T1,则正反应一定是吸热反应 | D、b点时,平衡体系中A、B原子数之比一定是1:1 |

