网址:http://m.1010jiajiao.com/timu3_id_88166[举报]
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表 :
:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
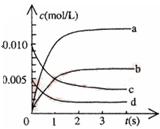
(2)如图中表示NO2的变化的曲线是 。用O2表示从0~2s内该反应的平均速率v=

(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应
 >
> ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂 查看习题详情和答案>>
 2NO2(g)体系中,n(NO)随时间的变化如表
2NO2(g)体系中,n(NO)随时间的变化如表 :
:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是 。用O2表示从0~2s内该反应的平均速率v=
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应
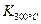 >
>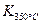 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为 。(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:

(1)写出该反应的平衡常数表达式:K=________,
已知:K(300℃)>K(350℃),该反应是________反应(填“放热”或“吸热”);
(2)下图中表示NO2的变化的曲线是________,用O2的浓度变化表示从0~2 s内该反应的平均速率v=________;
(3)能说明该反应已经达到平衡状态的是________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
(5)若将容器体积缩小至1 L,反应达到平衡时的平衡常数________(填“增大”、“减小”或“不变”).
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示:| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) |
0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
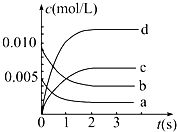
(2)如图所示,表示NO2变化的曲线是
(3)不能说明该反应已达到平衡状态的是
a.容器内压强保持不变 b.v (NO2)=2v(O2)
c.容器内密度保持不变 d.2v逆(NO)=v正(O2)
在
2 L密闭容器内,800℃时反应:2NO(g)+O2(g)

(1)写出该反应的平衡常数表达式:K=________.
已知:K300℃>K350℃,则该反应是________热反应.
(2)下图中表示NO2的变化的曲线是________;用O2表示从0~2 s内该反应的平均速率v=________;

(3)能说明该反应已达到平衡状态的是________.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________.
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂