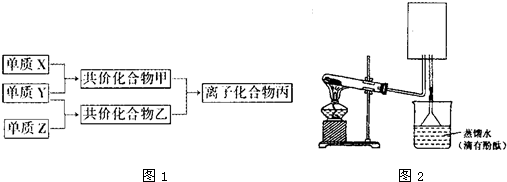
摘要:12.短周期元素的单质X.Y.Z在通常状况下均为气态.并有下列转化关系: 已知:a.常见双原子单质分子中.X分子含共价键最多. b.甲分子含10个电子.乙分子含18个电子. (1)X的电子式是 . (2)实验室可用下图所示装置(缺少收集装置.夹持固定装置略去)制备并收集甲. ①在图中方框内绘出用烧瓶收集甲的仪器装置简图. ②试管中的试剂是 . ③烧杯中溶液由无色变为红色.其原因是 . (3)磷在Z中燃烧可生成两种产物.其中一种产物丁分子中各原子最外层不全是8电子结构.丁的化学式是 . (4)n mol丁与n mol丙在一定条件下反应.生成4n mol乙和另一化合物.该化合物蒸气的密度是相同状况下氢气的174倍.其化学式是 . [解析] 短周期除惰性气体外的气体单质有H2.N2.O2.F2.Cl2.由已知a知X为N2.由b知.甲为NH3.乙为HCl.丙为NH4Cl. (1)一定要从化学键的形成角度掌握常见物质的电子式.如N2.CO2.CH4.NH3.H2O.Na2O2等. (2)①NH3的收集应是向下排空气法.②NH3的制取用铵盐与碱反应.但铵盐一般不用NH4NO3.防止爆炸.碱一般用Ca(OH)2.不用NaOH.因NaOH对玻璃的腐蚀作用太强.③要注意“ . (3)P与Cl2反应生成PCl3和PCl5.PCl3的电子式为 各原子最外层均为8电子结构.所以丁为PCl5. (4)由“化学方程式中各物质的计量数之比等于物质的量之比 及质量守恒定律共同得出.n mol PCl5与n mol NH4Cl反应生成4n mol HCl.由质量守恒定律知所求物分子中P.N.Cl的原子个数比为N(P)∶N(N)∶N(Cl)=1∶1∶2.所求物的相对分子质量为174×2.二者结合得出未知物的化学式为P3N3Cl6. [答案] (1)∶N⋮⋮N∶ (2)① ②NH4Cl.Ca(OH)2 ③NH3·H2ONH+OH- (3)PCl5 (4)P3N3Cl6
网址:http://m.1010jiajiao.com/timu3_id_88096[举报]
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:a.常见双原子单质分子中,X分子含共价键最多.b.甲分子中含10个电子,乙分子含有18个电子.
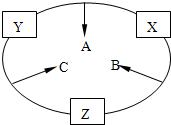
实验室可用如图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲.

①在图中方框内绘出用烧瓶收集甲的仪器装置简图.
②试管中的试剂是(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
查看习题详情和答案>>

已知:a.常见双原子单质分子中,X分子含共价键最多.b.甲分子中含10个电子,乙分子含有18个电子.
实验室可用如图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲.

①在图中方框内绘出用烧瓶收集甲的仪器装置简图.
②试管中的试剂是(填写化学式)
NH4Cl和Ca(OH)2
NH4Cl和Ca(OH)2
.③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.短周期元素的单质X、Y、Z在通常状况下均为气态,并有如图1所示的转化关系(反应条件略去).
已知:①常见双原子单质分子中,X分子含共价键最多.
②甲分子含10个电子,乙分子含18个电子.
(1)X的电子式是
 .
.
(2)实验室用如图2所示装置制备并收集甲.(缺少收集装置,夹持固定装置略去)
①在图2方格内绘出用烧瓶收集甲的仪器装置简图
 .
.
②试管中的试剂是(填写化学式)
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是
(4)n mol丁与n mol 丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是
查看习题详情和答案>>

已知:①常见双原子单质分子中,X分子含共价键最多.
②甲分子含10个电子,乙分子含18个电子.
(1)X的电子式是


(2)实验室用如图2所示装置制备并收集甲.(缺少收集装置,夹持固定装置略去)
①在图2方格内绘出用烧瓶收集甲的仪器装置简图


②试管中的试剂是(填写化学式)
Ca(OH)2和NH4Cl
Ca(OH)2和NH4Cl
.(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是
PCl5
PCl5
.(4)n mol丁与n mol 丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是
P3N3Cl6
P3N3Cl6
.短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):已知:
a.常见双原子单质分子中,X分子含共价键最多.
b.甲分子中含10个电子,乙分子含有18个电子.

(1)写出X的结构式是
 .
.
(2)化合物丙中含有化学键的类型
查看习题详情和答案>>
a.常见双原子单质分子中,X分子含共价键最多.
b.甲分子中含10个电子,乙分子含有18个电子.

(1)写出X的结构式是
N≡N
N≡N
;甲的电子式是

(2)化合物丙中含有化学键的类型
离子键、共价键(或极性键)
离子键、共价键(或极性键)
. 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知:B分子组成中Z原子个数比C分子中少一个,A是一种无色气体,遇空气变成红棕色.
请回答下列问题:
(1)元素Y在周期表中的位置为
第二周期、ⅤA族
第二周期、ⅤA族
.(2)物质C的电子式为
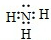
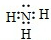
(3)X、Y、Z三种元素原子半径大小顺序为
N>O>H
N>O>H
(用元素符号表示).(4)B与C的稳定性大小顺序为
H2O>NH3
H2O>NH3
(用化学式表示).(5)C与X在一定条件下生成无色气体A的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
 短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):