网址:http://m.1010jiajiao.com/timu3_id_87673[举报]

(1)装置B中发生反应的化学方程式是______________________。
(2)装置E中的现象是______________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:______________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①步骤Ⅰ中通入Cl2的作用是________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)________________
_____________________________________________________________________。
查看习题详情和答案>>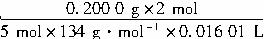
(1)装置C中盛放NaOH溶液的作用是__________________________________。
(2)①证明分解产物中有CO2的现象是__________________________________。
②证明分解产物中有CO的现象是_____________________________________。
(3)实验结束后,装置F中黑色氧化铜变为红色固体。简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):_____________________________________________________________________。
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化。KMnO4和草酸钠在稀硫酸中反应的离子方程式是______________________________________________。
②实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取0.200 0 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,用配置好的KMnO4溶液滴定。当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30 s内不褪色,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 |
滴定管液面刻度 | 0.00 mL | 16.02 mL | 16.00 mL | 16.01 mL |
KMnO4溶液的物质的量浓度的计算式是:?
c(KMnO4)=_________________。
查看习题详情和答案>>某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO(图中夹持装置已略去)。
(1)装置C的作用是 _______,装置E的作用是 。
(2)乙二酸受热分解的反应方程式是 。
(3)①证明分解产物中有CO2的现象是 _______________________。
②证明分解产物中有CO的现象是__ ______。
(4)该装置有一个不足之处,请写出弥补这个不足之处的理由和具体方法:_____________ __________ __________。
查看习题详情和答案>>
 (1)装置C的作用是 _______,装置E的作用是 。
(1)装置C的作用是 _______,装置E的作用是 。 (1)装置C的作用是
_______,装置E的作用是
。
(1)装置C的作用是
_______,装置E的作用是
。