网址:http://m.1010jiajiao.com/timu3_id_87175[举报]
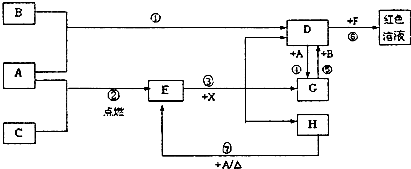
(1)写出下列物质的化学式:D
(2)在反应①~⑦中,不属于氧化还原反应的是
(3)反应⑥的离子方程式为:
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为

(1)写出化学式:A 、D 、E 、X 。?
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。?
(3)反应⑥的离子方程式为 ;D除了可与F反应得到一种红色溶液外,还可与某有机物反应生成紫色物质,该有机物是(填名称) 。?
(4)反应⑦的化学方程式为 ;该反应中每消耗0.3 mol的A,可转移电子 mol。?
(5)写出D的溶液与小苏打溶液反应的离子方程式:?
。
查看习题详情和答案>>
(1)A元素位于周期表中第________周期________族。D的化学式___________;X的电子式______________。
(2)在反应①—⑥中,不属于氧化还原反应的是______________(填编号)。
(3)往F溶液中加入NaOH溶液观察到的现象是______________。
(4)已知反应⑥中消耗
(5)写出下列反应的离子方程式:
D的水溶液与小苏打溶液混合____________________________。
向含有3 mol F的溶液中通入4 mol Cl2的离子反应方程式为______________。
查看习题详情和答案>>
(1)A元素位于周期表中第________周期_________族。D的化学式_______________;X的电子式_______________。
(2)在反应①—⑥中,不属于氧化还原反应的是_______________(填编号)。
(3)往F溶液中加入NaOH溶液观察到的现象是_______________。
(4)已知反应⑥中消耗
(5)写出下列反应的离子方程式:
D的水溶液与小苏打溶液混合______________________________。
向含有3 mol F的溶液中通入4 mol Cl2的离子反应方程式为_______________________。
查看习题详情和答案>>(11分)A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为液体、C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
(1)写出下列物质的化学式: D___________; X____________;
(2)在反应①~⑦中,不属于氧化还原反应的是______(填编号)。
(3)反应⑥的离子方程式为:_____________________________________________________
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为______________________________________________________;
该反应中每消耗0.3mol的A,可转移电子_______________mol。
(6)写出D的溶液与小苏打溶液反应的离子方程式为________________________________。
查看习题详情和答案>>