摘要:(一)必考题 26. 0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示. 请回答下列问题: (1)试确定200℃时固体物质的化学式 , (2)取270℃所得样品.于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体.该反应的化学方程式为 .把该黑色粉末溶解于稀硫酸中.经浓缩.冷却.有晶体析出.该晶体的化学式为 .其存在的最高温度是 , (3)上述氧化性气体与水反应生成一种化合物.该化合物的浓溶液与Cu在加热时发生反应的化学方程式为 , (4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成.当溶液的pH=8时.c(Cu2+)= mol·L-1(Kap[Cu(OH)2]=2.2×10-20). 若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体.使Cu2+完全沉淀为CuS.此时溶液中的H+浓度是 mol·L-1. 解释:(1)由图分析可知.CuSO4·5H2O受热到102℃时开始脱水分解.113℃时可得到较稳定的一种中间物.到258℃时才会继续分解.在200℃时失去的水的质量为0.57g.有差量法可以计算. CuSO4·5H2OCuSO4·(5-n)H2O+n H2O 250 18n 0.80g 0.80g-0.57g=0.23g n=4 (2) 570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体.是CuO和SO3.CuO与稀硫酸反应的产物是硫酸铜和水.蒸发浓缩的晶体为CuSO4·5H2O.其存在的最高温度为102℃. (3) SO3与水反应生成硫酸.与铜加热反应:2H2SO4(浓)+ CuCuSO4 +SO2↑+H2O (4)根据溶度积的概念可以直接计算.pH=8时.c(OH-)=10-6.由c(Cu2+)·c(OH-)2= Kap[Cu(OH)2]可得.c(Cu2+)=(2.2×10-20)/10-12=2.2×10-8 .在0.1mol·L-1硫酸铜溶液中通入过量H2S气体.使Cu2+完全沉淀为CuS.溶液中溶质为硫酸.c(SO42-)不变.为0.1mol·L-1 .c(H+)为0.2mol·L-1. 答案:(1)CuSO4·H2O CuSO4·5H2OCuSO4·(5-n)H2O+n H2O 250 18n 0.80g 0.80g-0.57g=0.23g n=4 (2) CuSO4 CuO+SO3↑.CuSO4·5H2O. 102℃ (3) 2H2SO4(浓)+ CuCuSO4 +SO2↑+H2O (4)2.2×10-8 .0.2 27.科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.并开发出直接以甲醇为燃料的燃料电池.已知H2和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1.-283.0kJ·mol-1和-726.5kJ·mol-1.请回答下列问题: (1)用太阳能分解10mol水消耗的能量是 kJ, (2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 , (3)在容积为2L的密闭容器中.由CO2和H2合成甲醇.在其他条件不变得情况下.考察温度对反应的影响.实验结果如下图所示(注:T1.T2均大于300℃), 下列说法正确的是 ①温度为T1时.从反应开始到平衡.生成甲醇的平均速率为 v(CH3OH)= mol·L-1·min-1 ②该反应在T1时的平衡常数比T2时的小 ③该反应为放热反应 ④处于A点的反应体系从T1变到T2.达到平衡时增大 (4)在T1温度时.将1molCO2和3molH2充入一密闭恒容器中.充分反应达到平衡后.若CO2转化率为a,则容器内的压强与起始压强之比为 , (5)在直接以甲醇为燃料电池中.电解质溶液为酸性.负极的反应式为 .正极的反应式为 .理想状态下.该燃料电池消耗1mol甲醇所能产生的最大电能为702.1KJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比) 解释:(1)由H2(g)的燃烧热△H为-285.8kJ·mol-1知.1mol H2(g)完全燃烧生成1mol H2O(g)放出热量285.8kJ.即分解1mol H2O(g)为1mol H2(g)消耗的能量为285.8kJ.分解10mol H2O(g)为10mol H2(g)消耗的能量为2858kJ. (2)写出燃烧热的热化学方程式: CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1 ① CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l) △H=-726.5kJ·mol-1 ② 用②-①得: CH3OH(l)+ O2+2 H2O(l) △H=-443.5kJ·mol-1 (3)根据图像分析.由先拐先平数值大原则.T2>T1.温度升高.生成物的平衡时的物质的量减少.故正反应为放热反应. ①中速率用物质的量与时间之比.错误.应该为物质的量浓度与时间之比. ②该反应的正反应为放热反应.T2>T1.所以T1时的平衡常数比T2时的大. ③正确 ④处于A点的反应体系从T1变到T2.升高温度.平衡向逆反应方向移动.达到平衡时增大.正确. (4)利用化学平衡的三段模式法计算: CO2 (g)+3H2(g)= CH3OH(g) +2H2O(g) 起始 1 3 0 0 变化 a 3 a a a 平衡 1-a 3-3a a a 根据压强之比等于物质的量之比.则 容器内的压强与起始压强之比为:/4=1-a/2 (5)这是一个典型的燃料电池的电极反应的书写.电池的理论效率的计算可由消耗1mol甲醇所能产生的最大电能与其燃烧热之比即可求得.702.1/726.5=96.6% 答案:(1) 2858 (2) CH3OH(l)+ O2+2 H2O(l) △H=-443.5kJ·mol-1 (3) ③④ (4)1-a/2 (5) CH3OH(g) +H2O-6e-= CO2 +6H+ 3/2O2 + +6H+ +6e-= 3H2O 96.6% 28. 氢化钙固体登山运动员常用的能源提供剂.某兴趣小组长拟选用如下装置制备氢化钙. 请回答下列问题: (1)请选择必要的装置.按气流方向连接顺序为 (2)根据完整的实验装置进行实验.实验步骤如下:检查装置气密性后.装入药品,打开分液漏斗活塞 (请按正确的顺序填入下列步骤的标号). A.加热反应一段时间 B.收集气体并检验其纯度 C.关闭分液漏斗活塞 D.停止加热.充分冷却 (3)实验结束后.某同学取少量产物.小心加入水中.观察到有气泡冒出.溶液中加入酚酞后显红色.该同学据此断.上述实验确有CaH2生成. ① 写出CaH2与水反应的化学方程式 ②该同学的判断不正确.原因是 (4)请你设计一个实验.用化学方法区分钙与氢化钙.写出实验简要步骤及观察到的现象 . (5)登山运动员常用氢化钙作为能源提供剂.与氢气相比.其优点是 . 解释:(略) 答案: (1)i→e.f→d.c→j.k k→a (2) BADC (3) CaH2+2H2O=Ca(OH)2+2H2↑ 金属钙与水反应也有类似现象 (4) 取适量的氢化钙.在加热的条件下雨干燥氧气反应.将反应后生成的气态产物通过装有白色的无水硫酸铜的干燥管.观察到白色变蓝色.而取钙做相同的实验则观察不到白色变蓝色. (5) 氢化钙是固体携带方便
网址:http://m.1010jiajiao.com/timu3_id_86373[举报]
硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4?5H2 O)和副产物石膏(CaSO4?2H2O)的生产流程示意图:
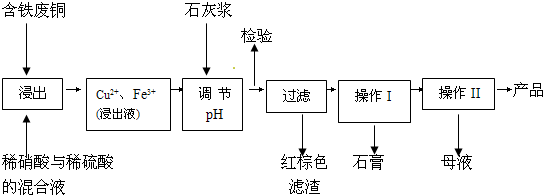
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的离子方程式
(3)操作I包括蒸发浓缩、
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是
②指出你认为不合理方案存在的问题是
查看习题详情和答案>>

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
Fe(OH)3
Fe(OH)3
;(2)写出浸出过程中生成硫酸铜的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
;(3)操作I包括蒸发浓缩、
趁热过滤
趁热过滤
等操作,温度应该控制在100
100
℃左右;(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为
冷却结晶
冷却结晶
、过滤
过滤
、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是减少因晶体溶解而造成的损失
减少因晶体溶解而造成的损失
;干燥时采用晾干,不用加热烘干的原因是避免加热过程中晶体受热分解
避免加热过程中晶体受热分解
.(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是
方案二
方案二
;②指出你认为不合理方案存在的问题是
Cu2+的蓝色对检验有干扰
Cu2+的蓝色对检验有干扰
.80℃时,2L 密闭容器中充入0.40mol N2O4,发生反应N2O4═2NO2△H=+Q kJ?mol-1(Q>0),获得如下数据:
下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol?L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A、升高温度该反应的平衡常数K减小 |
| B、20~40s 内,v(N2O4)=0.004mol?L-1?s1 |
| C、反应达平衡时,吸收的热量为0.30Q kJ |
| D、100s时再通入0.40mol N2O4,达新平衡时N2O4的转化率增大 |
(2009?徐汇区二模)硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4?5H2O)的生产流程示意图:
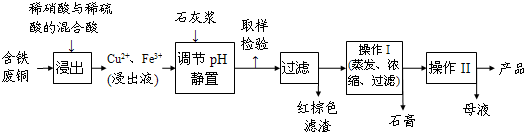
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
(1)红棕色滤渣的主要成分是
(2)写出浸出过程中生成硫酸铜的化学方程式
(3)操作I的操作温度应该控制在
(4)从溶液中分离出硫酸铜晶体的操作II应为
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
②指出你认为不合理的方案存在的问题
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
查看习题详情和答案>>

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是
Fe(OH)3
Fe(OH)3
;(2)写出浸出过程中生成硫酸铜的化学方程式
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
;(3)操作I的操作温度应该控制在
100
100
℃左右;(4)从溶液中分离出硫酸铜晶体的操作II应为
冷却结晶、过滤
冷却结晶、过滤
、洗涤、干燥;(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
方案二
方案二
;②指出你认为不合理的方案存在的问题
Cu2+的蓝色对检验有干扰
Cu2+的蓝色对检验有干扰
;(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
4NO+3O2+H2O=4HNO3
4NO+3O2+H2O=4HNO3
.(2013?浙江模拟)必考题二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:请填空:

(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
①P1
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率
③在P1压强下,100℃时,CH3OH(g) CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为
(用含a、V的代数式表示).
查看习题详情和答案>>

(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将减小
减小
(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=0.0003mol?L-1?min-1
0.0003mol?L-1?min-1
.(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为
2CO+4H2 CH3OCH3+H2O
CH3OCH3+H2O
 CH3OCH3+H2O
CH3OCH3+H2O2CO+4H2 CH3OCH3+H2O
CH3OCH3+H2O
. CH3OCH3+H2O
CH3OCH3+H2O(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:①P1
<
<
P2 (填“<”、“>”或“=“).②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“减小”或“不变”.下同.),平衡常数不变
不变
.③在P1压强下,100℃时,CH3OH(g)
 CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| a2 |
| V2 |
| a2 |
| V2 |
(2010?崇文区二模)硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4?5H2O)的生产流程示意图:
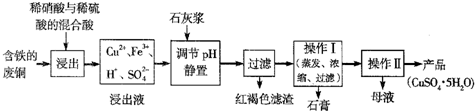
胆矾和石膏在不同温度下的溶解度(∥100g水)见下表.
请回答下列问题:①红褐色滤渣的主要成分是
②写出浸出过程中生成硫酸铜的化学方程式
③操作I的温度应该控制在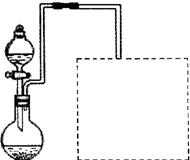
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体).
查看习题详情和答案>>
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4?5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(∥100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
Fe(OH)3
Fe(OH)3
;②写出浸出过程中生成硫酸铜的化学方程式
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
;③操作I的温度应该控制在
100℃
100℃
左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液
冷却结晶
冷却结晶
、过滤
过滤
、洗涤、干燥.(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用仪器和加热装置未画出).
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内.该实验中对圆底烧瓶加热的最佳方式是
水浴
水浴
加热;②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体).