网址:http://m.1010jiajiao.com/timu3_id_86279[举报]
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备Mg0的实验方案( )
已知:Kap[Mg(OH)4]=5.61×10-12 下列说法正确的是( ) |
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
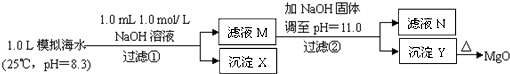 |
(2011?浙江)海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
|
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

注:溶液中某种离子的浓度小于1.0×10-5mo1/L,可认为该离子不存在;
已知:Ksp(CaCO3)= 4.96×10-9; Ksp(MgCO3)= 6.82× 10-6;
Ksp[Ca(OH)2]=4.68×l0-6; Ksp[Mg(OH)2]=5.61×l0-12。
下列说法正确的是(假设实验过程中溶液体积不变) ( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看习题详情和答案>>
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:

(1)工业制取镁的方法是 法。
(2)试剂Ⅰ一般选用 (填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。

①由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式 。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因 。
查看习题详情和答案>>