摘要: W.X.Y.Z是四种常见的短周期元素.其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18.中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的电负性在同周期主族元素中最大. (1)X位于元素周期表中第 周期第 族,W的基态原子核外有 个未成对电子. (2)X的单质子和Y的单质相比.熔点较高的是 ,Z的气态氢化物和溴化氢相比.较稳定的是 . (3)Y与Z形成的化合物和足量水反应.生成一种弱酸和一种强酸.该反应的化学方程式是 . (4)在25ºC.101 kPa下.已知Y的气态化物在氧气中完全燃烧后恢复至原状态.平均每转移1mol 电子放热190.0kJ.该反应的热化学方程式是 . 解析:因为W的一种核素的质量数为18.中子数为10.说明W的质子数为8.即为氧元素,Y的单质是一种常见的半导体材料.而在短周期元素中只有元素硅符合.即Y是Si,所以由图像中原子半径的大小顺序可知X.Y.Z应该属于第三周期元素.在第三周期主族元素中电负性最大的Cl元素.所以Z是Cl,又因为X和Ne原子的核外电子数相差1.且X位于第三周期.所以X是Na. (1)O的原子电子排布式是1S22S22P4.所以O的基态原子核外有2个未成对电子, (2)单质钠和硅分别属于金属晶体和原子晶体.故单质硅的熔点高,Cl的非金属性强于Br的.所以HCl比HBr稳定, (3)Y与Z形成的化合物是SiCl4.SiCl4可以和水发生水解反应盐酸和硅酸.反应的化学方程式是:SiCl4+3H2O=H2SiO3↓+4HCl, (4)Y的气态化物是SiH4.燃烧后生成二氧化硅.其中Si的化合价由-4价升高到+4价.转移8个电子.所以1mol SiH4共放出8×190.0kJ=1520.0KJ能量.因此反应的热化学方程式是:SiH4(g)+2O2(g)=SiO2(s)+2H2O △H=-1520.0KJ/mol 答案:Si HCl (3)SiCl4+3H2O=H2SiO3↓+4HCl (4)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1520.0KJ/mol
网址:http://m.1010jiajiao.com/timu3_id_86252[举报]
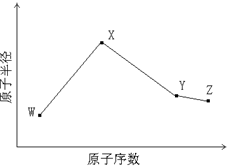 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.(1)Y在周期表中的位置是
(2)用电子式解释X与W能形成化合物X3W的原因
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是
(5)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B (g)?2A(g)△H=-92.4kJ?mol-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第10min改变了反应条件,改变的条件可能是
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度.
 (2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(2011?安徽)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(1)X位于元素周期表中第
三
三
周期第ⅠA
ⅠA
族;W的基态原子核外有2
2
个未成对电子.(2)X的单质和Y的单质相比,熔点较高的是
Si
Si
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl
HCl
(写化学式).(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是
SiCl4+3H2O═H2SiO3+4HCl
SiCl4+3H2O═H2SiO3+4HCl
.(4)在25°C、101kPa下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是
SiH4(g)+2O2(g)
SiO2(s)+2H2O(l)△H=-1520kJ/mol
| ||
SiH4(g)+2O2(g)
SiO2(s)+2H2O(l)△H=-1520kJ/mol
.
| ||
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)(1)X的原子结构示意图为


2
2
个未成对电子.(2)XZ与X2W都属于
离子
离子
晶体(写晶体类型);其熔点较高的是Na2O
Na2O
(写化学式),原因是氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大
氯离子的半径大于氧离子半径,氧化钠中核间距小且氧离子所带电荷多,氧化钠的晶格能大
.(3)YZ4和足量的水反应,生成一种弱酸和一种强酸,该反应的化学方程式是
SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+4H2O=H4SiO4↓+4HCl
. (2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
(2013?济宁一模)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
查看习题详情和答案>>
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z是是同周期中非金属性最强的元素.
(1)X位于元素周期表的位置
第三周期、IA族
第三周期、IA族
,X与硫元素形成的化合物的电子式为

(2)Z的气态氢化物和溴化氢相比,较稳定的是
HCl
HCl
(写化学式).理由为氯元素的非金属性强于溴元素,所以HCl比HBr稳定
氯元素的非金属性强于溴元素,所以HCl比HBr稳定
.(3)Y与Z形成的化合物硬度小、熔点低、沸点低,其晶体中有存在的作用力有
范德华力(或分子间作用力)极性共价键(或共价键)
范德华力(或分子间作用力)极性共价键(或共价键)
其分子属于
非极性分子
非极性分子
(填极性分子、非极性分子),它和足量水反应,有白色胶状沉淀产生,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+3H2O=H2SiO3↓+4HCl或SiCl4+4H2O=H4SiO4↓+4HCl
.(4)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0kJ/mol
.