摘要: (1)小 (2)CH2===CH2+H2O―→CH3CH2OH 100% (3)D E (4)①3 ②2CH3CH2OH+O2Cu△2CH3CHO+2H2O ③BCD
网址:http://m.1010jiajiao.com/timu3_id_85697[举报]
(2009?合肥三模)2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
查看习题详情和答案>>
实验室里用乙醇和浓硫酸反应生成乙烯,接着再用溴与之反应生成1,2-二溴乙烷.在制备过程中由于部分乙醇被浓硫酸氧化还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体.
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷.

如果气体流向为从左到右,正确的连接顺序是:
(1)经A(1)B插入A中,D接A(2);A(3)接
(2)温度计水银球的正确位置是
(3)F的作用是
(4)在三颈烧瓶A中的主要反应的化学方程式为
(5)在反应管E中进行的主要反应的化学方程式为
(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为
查看习题详情和答案>>
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷.

如果气体流向为从左到右,正确的连接顺序是:
(1)经A(1)B插入A中,D接A(2);A(3)接
C
C
接F
F
接E
E
接G
G
.(2)温度计水银球的正确位置是
插入三颈烧瓶中的液体中
插入三颈烧瓶中的液体中
,若用分液漏斗代替D,可能会产生的问题是容器内压力过大时液体无法滴落
容器内压力过大时液体无法滴落
.(3)F的作用是
除去三颈瓶中产生的CO2、SO2
除去三颈瓶中产生的CO2、SO2
,G的作用是吸收挥发的溴蒸汽
吸收挥发的溴蒸汽
.(4)在三颈烧瓶A中的主要反应的化学方程式为
CH3CH2OH
CH2=CH2↑+H2O
| 浓H2SO4 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
.| 浓H2SO4 |
| 170℃ |
(5)在反应管E中进行的主要反应的化学方程式为
CH2═CH2+Br2→BrCH2CH2Br
CH2═CH2+Br2→BrCH2CH2Br
.(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为
减少溴的挥发损失
减少溴的挥发损失
.(2013?崇明县一模)已知:①不饱和碳上的氢可与1,3-丁二烯发生1,4加成.如:CH2=CH2+CH2=CH-CH=CH2

②(CH3)2C═CHCH3
CH3-C-CH3+CH3+CH3COOH聚-3-羟基丁酸酯(PHB),可用于制造可降解塑料等,它由3-羟基丁酸[CH3CH(OH)CH2COOH]分子聚合而成.合成聚-3-羟基丁酸酯的途径很多,其中有一种途径的副产物少、污染小、原子利用率高,其合成路线如下:

试回答下列问题:
(1)下列关于CH2=CH-CH=CH2的叙述中,正确的是
A.CH2=CH-CH=CH2可以通过加聚反应合成天然橡胶
B.CH2=CH-CH=CH2中的原子可能在同一平面上
C.CH2=CH-CH=CH2可以一步合成
D.CH2=CH-CH=CH2能与溴水、酸性高锰酸钾发生加成反应而使之褪色
(2)上述转化过程中属于加成反应的是
(3)反应②符合绿色化学思想(原料中碳原子100%转化成产物,不产生副产物),则A的结构简式为
 .
.
(4)写出反应④的化学方程式
 .
.
(5)写出两种能发生银镜反应,且能与氢氧化钠溶液发生水解反应的C的同分异构体的结构简式.
 、
、
 .
.
(6)为研究物质的芳香性,可将CH≡C-CH3三聚得到苯的同系物,写出产物可能的结构简式. 、
、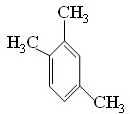
 、
、 .
.
查看习题详情和答案>>
| △ |

②(CH3)2C═CHCH3
| KMnO4 |
| H+ |

试回答下列问题:
(1)下列关于CH2=CH-CH=CH2的叙述中,正确的是
BC
BC
A.CH2=CH-CH=CH2可以通过加聚反应合成天然橡胶
B.CH2=CH-CH=CH2中的原子可能在同一平面上
C.CH2=CH-CH=CH2可以一步合成

D.CH2=CH-CH=CH2能与溴水、酸性高锰酸钾发生加成反应而使之褪色
(2)上述转化过程中属于加成反应的是
①、③
①、③
(填序号).(3)反应②符合绿色化学思想(原料中碳原子100%转化成产物,不产生副产物),则A的结构简式为


(4)写出反应④的化学方程式


(5)写出两种能发生银镜反应,且能与氢氧化钠溶液发生水解反应的C的同分异构体的结构简式.




(6)为研究物质的芳香性,可将CH≡C-CH3三聚得到苯的同系物,写出产物可能的结构简式.
 、
、
 、
、
以电化学方法合成有机物称为有机电合成.有机电合成是一门有机化学、电化学和化学工程多学科相互交叉的科学,是电化学在有机物化工生产中的重要应用.因而,有机电合成被称为“古老的方法,崭新的技术”.有机电合成的研究已经历了170多年漫长的历史.早在1834年,英国化学家Faraday用电解醋酸钠溶液制得乙烷,可以说是在实验室中最早实现的有机电合成.
2CH3COO--2e-=C2H6↑+2CO2↑ (a)
(1)上述反应(a)发生于 (填“电解池”或“原电池”)的 极.
(2)许多有机物在特定的装置内进行氧化的同时还可产生电能,这种装置即为燃料电池.例如,乙烯被氧化生成乙醛的化学反应:2CH2=CH2+O2→2CH3CHO可设计成燃料电池:
负极:CH2=CH2+H2O-2e-=CH3CHO+2H+正极:
电池工作时,负极附近溶液的pH (填“升高”、“降低”或“不变”).
(3)燃料电池由于具有能量转化效率高、对环境污染小等优点而受到世界各国的普遍重视.
燃料电池与火力发电的大气污染比较(单位:kW?h)
①根据表所给数据可以看出, 造成的污染最为严重,引起的环境问题主要有 及酸雨.
A.水华 B.臭氧层被破坏 C.光化学烟雾 D.潮汐 E.白色污染②在我国导致酸雨的主要气体为SO2,将SO2回收处理的方法很多,其中一种是将SO2通入石灰乳[Ca(OH)2]中,可制得石膏[CaSO4?2H2O].请写出相应的化学方程: 及
CaSO4+2H2O=CaSO4?2H2O.
查看习题详情和答案>>
2CH3COO--2e-=C2H6↑+2CO2↑ (a)
(1)上述反应(a)发生于
(2)许多有机物在特定的装置内进行氧化的同时还可产生电能,这种装置即为燃料电池.例如,乙烯被氧化生成乙醛的化学反应:2CH2=CH2+O2→2CH3CHO可设计成燃料电池:
负极:CH2=CH2+H2O-2e-=CH3CHO+2H+正极:
电池工作时,负极附近溶液的pH
(3)燃料电池由于具有能量转化效率高、对环境污染小等优点而受到世界各国的普遍重视.
燃料电池与火力发电的大气污染比较(单位:kW?h)
| 污染成分 | 天然气火力发电 | 重油火力发电 | 煤火力发电 | 燃料电池 |
| SO2 | 2.5~230 | 4550 | 8200 | 0~0.12 |
| NOx | 1800 | 3200 | 3200 | 63~107 |
| 烃类 | 20~1270 | 135~5000 | 30~10000 | 14~102 |
| 尘末 | 0~90 | 45~320 | 365~680 | 0~0.14 |
A.水华 B.臭氧层被破坏 C.光化学烟雾 D.潮汐 E.白色污染②在我国导致酸雨的主要气体为SO2,将SO2回收处理的方法很多,其中一种是将SO2通入石灰乳[Ca(OH)2]中,可制得石膏[CaSO4?2H2O].请写出相应的化学方程:
CaSO4+2H2O=CaSO4?2H2O.
(2010?江苏二模)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
2CuCl2+SnCl2═2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
(2)SO2分子的空间构型为
(3)乙二胺分子中氮原子轨道的杂化类型为
(4)②中所形成的配离子中含有的化学键类型有
(5)CuCl的晶胞结构如下图所示,其中Cl原子的配位数为

查看习题详情和答案>>
已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O
| ||
2CuCl2+SnCl2═2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
,H、N、O三种元素的电负性由大到小的顺序是O>N>H
O>N>H
.(2)SO2分子的空间构型为
V形
V形
,与SnCl4互为等电子体的一种离子的化学式为SO42-、SiO44-
SO42-、SiO44-
.(3)乙二胺分子中氮原子轨道的杂化类型为
sp3杂化
sp3杂化
,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
.(4)②中所形成的配离子中含有的化学键类型有
abd
abd
.a.配位键 b.极性键 c.离子键 d.非极性键(5)CuCl的晶胞结构如下图所示,其中Cl原子的配位数为
4
4
.