摘要:(1)增大反应物的接触面积(或加快反应速率或使反应充分进行) (2)碘(I2)或碘酒 (3)C (4)制饮料.制干冰.制纯碱.制碳酸钙等中任选2个 (5)56.8 kg
网址:http://m.1010jiajiao.com/timu3_id_85677[举报]
(1)在下列事实中,什么因素影响了化学反应的速率?
①同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢:
②同样大小的石灰石分别在0.1mol?L-1的盐酸和1mol?L-1的盐酸中反应速率不同:
③煤的燃烧被研得越细越好:
④实验室用锌和稀硫酸制氢气时在反应液中中少量的五水硫酸铜晶体,冒出气泡明显增加:
(2)合成NH3反应:N2(g)+3H2(g) 2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
查看习题详情和答案>>
①同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢:
反应物本身的性质
反应物本身的性质
.②同样大小的石灰石分别在0.1mol?L-1的盐酸和1mol?L-1的盐酸中反应速率不同:
反应物的浓度
反应物的浓度
.③煤的燃烧被研得越细越好:
反应物的接触面积
反应物的接触面积
④实验室用锌和稀硫酸制氢气时在反应液中中少量的五水硫酸铜晶体,冒出气泡明显增加:
Zn与CuSO4反应生成Cu与Zn组成微型原电池(或发生原电池反应)
Zn与CuSO4反应生成Cu与Zn组成微型原电池(或发生原电池反应)
(2)合成NH3反应:N2(g)+3H2(g)
 2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是: 已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:(1)实验中生成X的化学方程式是
HClO4+F2=ClO4F+HF
HClO4+F2=ClO4F+HF
;(2)现有10%和30%的HClO4,李明最好选用
30%的HClO4
30%的HClO4
,理由是浓度增大,反应速率加快
浓度增大,反应速率加快
;(3)B中冷却剂选用液氧的理由是
因为液氧提供的低温可以使ClO4F成为固体,便于ClO4F的分离
因为液氧提供的低温可以使ClO4F成为固体,便于ClO4F的分离
;(4)A中填充环状物的作用是
增大F2与HClO4的接触面积,以提高反应速率,有利于反应朝预定方向进行
增大F2与HClO4的接触面积,以提高反应速率,有利于反应朝预定方向进行
.某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:
请回答下列问题:
(1)实验③的现象是
(2)由实验③得出的实验结论是
(3)由实验②可得出决定化学反应快慢的主要因素是
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?
(5)通过实验④说明要加快化学反应速率可
查看习题详情和答案>>
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
(1)实验③的现象是
生成淡黄色沉淀
生成淡黄色沉淀
,该反应的离子方程式为S2-+Cl2=2Cl-+S↓
S2-+Cl2=2Cl-+S↓
,(2)由实验③得出的实验结论是
氯原子的得电子能力比硫原子强(或其它合理答案)
氯原子的得电子能力比硫原子强(或其它合理答案)
;(3)由实验②可得出决定化学反应快慢的主要因素是
反应物本身的性质
反应物本身的性质
;(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确?
否
否
(填是或否)(5)通过实验④说明要加快化学反应速率可
增大反应物的浓度
增大反应物的浓度
或增大反应物的接触面积
增大反应物的接触面积
.(2012?乐山二模)用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下: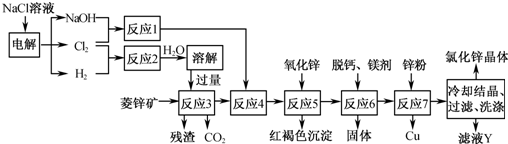
(1)在反应3前要将菱锌矿研磨,其目的是
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为
(4)锌粉不在反应4之前加入的原因是
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有
查看习题详情和答案>>

(1)在反应3前要将菱锌矿研磨,其目的是
增大反应物接触面积,使反应3反应速率加快
增大反应物接触面积,使反应3反应速率加快
.(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为
2Fe2++ClO-+2H+═2Fe3++Cl-+H2O
2Fe2++ClO-+2H+═2Fe3++Cl-+H2O
.(3)加入氧化锌调节pH=4.5,反应5的离子方程式为
ZnO+2H+═Zn2++H2O
ZnO+2H+═Zn2++H2O
、Fe3++3H2O?Fe(OH)3↓+3H+
Fe3++3H2O?Fe(OH)3↓+3H+
.(4)锌粉不在反应4之前加入的原因是
Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量
Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量
.(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有
H2、Cl2、Zn
H2、Cl2、Zn
.某课外兴趣小组对H2O2的分解速率做了科学探究采集的数据如下表:
(1)表一:用10mlH2O2制取150mlO2所需时间(秒)
请问:①该研究小组在设计方案时.考虑了浓度、
②从上述影响过氧化氢分解速率的因素中选一个说明该因素对分解速率有何影响?
(2)将质量相同但聚焦状态不同的MnO2分别加入到5ml5%的H2O2中,并用带火星木条测试,测定结果见表二:
③写出H2O2分解的化学方程式
④实验结果说明催化剂作用的大小与
查看习题详情和答案>>
(1)表一:用10mlH2O2制取150mlO2所需时间(秒)
时间(秒) 反应条件 浓度 |
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂加热 | 10 | 25 | 60 | 120 |
催化剂
催化剂
、温度
温度
等因素对过氧化氢分解速率的影响.②从上述影响过氧化氢分解速率的因素中选一个说明该因素对分解速率有何影响?
一般加入催化剂,反应速率加快(或,升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢)
一般加入催化剂,反应速率加快(或,升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢)
(2)将质量相同但聚焦状态不同的MnO2分别加入到5ml5%的H2O2中,并用带火星木条测试,测定结果见表二:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需及时间 |
| 粉末状 | 混合不振荡 | 剧烈反应、带火星木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
| ||
④实验结果说明催化剂作用的大小与
接触面积
接触面积
有关.