摘要:A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示。请按要求回答下列问题: (1)若B、C为氧化物,B转化为C时,质量增加25%,则B转化为C的化学方程式是 。 (2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是 ;将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是 。 (3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是 ;符合条件的D物质可能是 。 ①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡 解析:(1)由B、C是氧化物,可推知D为O2,则B、C是同种元素不同价态的氧化物,B转化为C时,质量增加25%,可推出A为S,B为SO2,C为SO3。(2)结合题中信息可知B、C为金属D的氯化物,结合转化关系,可推出D为变价金属Fe,故可推知A、B、C分别为:Cl2、FeCl3、FeCl2。(3)可推知A、C分别为Al3+(或AlO-2)与AlO-2(或Al3+),B是Al(OH)3;故A+C→B的离子方程式为:Al3++3AlO-2+6H2O=4Al(OH)3↓。由Al3+、AlO-2及Al(OH)3间的转化关系可推知D应是强酸或强碱,故符合条件的D可能是①、③。 答案:(1) (2)FeCl3 Fe2O3 (3)Al3++3AlO-2+6H2O=4Al(OH)3↓ ①③
网址:http://m.1010jiajiao.com/timu3_id_85453[举报]
现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉.现已知反应2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应
Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应
 5CaCl2+Ca(ClO3)2+6H2O.甲、乙、丙三人分别设计三个实验装置,如下图示:
5CaCl2+Ca(ClO3)2+6H2O.甲、乙、丙三人分别设计三个实验装置,如下图示:
(1)请从以下几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在表格内:
a.不容易控制反应速率
b.容易控制反应速率
c.有副反应发生
d.可防止副反应发生
e.污染环境
f.可防止污染环境
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向),组装一套较完善的实验装置(填编号)________.
(3)实验中若用12 mol/L的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol(假定各步反应均无反应损耗且无副反应发生),其可能的主要原因是________.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,已知C为密度最小的气体,甲是电解质.
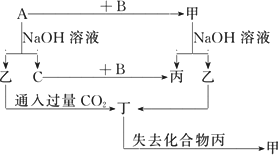
根据图示转化关系回答:
(1)写出下列物质的化学式:
A________,B________,乙________,丁________
.(2)组成单质A的元素在周期表中的位置是________,工业上制备A物质的化学反方程式是________.
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式________.
②乙与过量CO2反应的离子方程式________
.