摘要:4.短周期元素A.B.C.D的原子序数依次递增.它们的核电荷数之和为32.原子最外层电子数之和为10.A与C同主族.B与D同主族.A.C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( ) A.D元素处于元素周期表中第3周期第ⅥA族 B.四种元素的原子半径:A<B<C<D C.B.D的最高价氧化物具有相似的物理性质和化学性质 D.一定条件下.B单质能置换出D单质.C单质能置换出A单质 解析:根据信息可以推断A为氢.B为碳.C为钠.D为硅.硅处于元素周期表中第3周期第ⅣA族.A错.四种元素原子半径:Na>Si>C>H.B错.B.D的最高价氧化物分别为CO2.SiO2.CO2为分子晶体.熔沸点低,而SiO2为原子晶体.熔沸点高.C错.根据2C+SiO22CO↑+Si.2Na+2H2O===2NaOH+H2↑.D对. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_85271[举报]
(2008?南通二模)六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与 F同主族,E与F同周期.已知常温下单质A与E的状态:不同,D原子的核电荷 数是B原子最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
查看习题详情和答案>>
(2010?和平区一模)短周期元素a、b、c、d、e、f、g、h的原子序数依次增大,其中a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2;1mole单质能与冷水反应,在标准状况下生成11.2LH2;f原子最外层电子数等于其周期序数;h-的电子层结构与Ar原子相同.
(1)f原子结构示意图为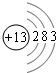
 ;d和e形成的化合物电子式为
;d和e形成的化合物电子式为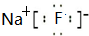
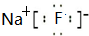 ;
;
(2)c和f简单离子的半径大小为
(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性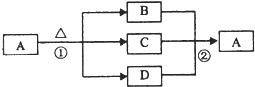
(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
②写出②反应的化学方程式
查看习题详情和答案>>
(1)f原子结构示意图为


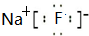
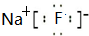
(2)c和f简单离子的半径大小为
O2->Al3+
O2->Al3+
;(用离子符号和“>”、“=”或“<”表示)(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①④
①④
(填序号);①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性

(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
NH4HSO3
NH4HSO3
.②写出②反应的化学方程式
SO2+NH3+H2O=NH4HSO3
SO2+NH3+H2O=NH4HSO3
.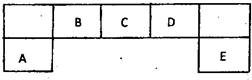 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题(1)描述D在元素周期表中的位置:
第二周期第ⅥA族
第二周期第ⅥA族
(2)比较A、C、D元素简单离子半径的大小:
N3-
N3-
>O2-
O2-
>Al3+
Al3+
(填微粒符号)(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:
N的非金属性比S强
N的非金属性比S强
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈
酸
酸
性,用离子方程式解释原因NH4++H2O?NH3.H2O+H+
NH4++H2O?NH3.H2O+H+
.(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式


(6)E的最高价氧化物的水化物的化学式为
HClO4
HClO4
.E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O
| ||
8HCl+KClO4
KCl+4Cl2↑+4H2O
.
| ||
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述正确的是( )
| A、D元素处于元素周期表中第3周期第IV族 | B、四种元素的原子半径:A<B<D<C | C、B、D的最高价氧化物中,B、D与氧原子之间均为双键 | D、一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
下表中列出六种短周期元素A、B、C、D、E、F的信息,请推断后同答:
(1)写出D元素最高价氧化物对应的水化物的电子式:
(2)盐X中包含的化学键类型为:
(3)设计实验验证A、B非金属性的强弱:
(4)工业制取D单质的反应方程式为:
(5)已知E元素的某种氢化物Y与C2的摩尔质量相同.Y与C2组成的燃料电池是一种碱性燃料电池,产物无污染.请写山该燃料电池负极反应式:
(6)F可用于焊接钢轨,有关的化学反应方程式:
引发该反应的操作是 .
查看习题详情和答案>>
| 元素 | 有关信息 |
| A | 所在主族序数与所在周期序数之差为4 |
| B | 原子半径为0.102nm,其两种常见氧化物的相对分子质量比为4:5 |
| C | 元素主要化合价为-2,原子半径为0.074nm |
| D | 最高价氧化物对应水化物溶于水能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075nm,最高价氧化物对应的水化物与其氢化物反应生成盐X |
| F | 原子的最外层电子数等于2n-3(n为电子层数),化学反应中易失去最外层电子形成Fn+ |
(2)盐X中包含的化学键类型为:
(3)设计实验验证A、B非金属性的强弱:
(4)工业制取D单质的反应方程式为:
(5)已知E元素的某种氢化物Y与C2的摩尔质量相同.Y与C2组成的燃料电池是一种碱性燃料电池,产物无污染.请写山该燃料电池负极反应式:
(6)F可用于焊接钢轨,有关的化学反应方程式:
引发该反应的操作是