摘要:14.工业生产纯碱的工艺流程示意图如下: 完成下列填空: (1)粗盐水加入沉淀剂A.B除杂质(沉淀剂A来源于石灰窑厂).写出A.B的化学式. A. .B. . (2)实验室提纯粗盐的实验操作依次为: 取样. .沉淀. . .冷却结晶. .烘干. (3)工业生产纯碱工艺流程中.碳酸化时产生的现象是 .碳酸化时没有析出碳酸钠晶体.其原因是 . (4)碳酸化后过滤.滤液D最主要的成分是 .检验这一成分的阴离子的具体方法是: . (5)氨碱法流程中氨是循环使用的.为此.滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方式程为: .滤液D加石灰水前先要加热.原因是 . (6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数.纯碱中碳酸氢钠的质量分数可表示为: . 解析:(1)粗盐中含Ca2+.Mg2+.加入石灰乳或CaO可除去Mg2+.再加入Na2CO3除去Ca2+.因此A为Ca(OH)2或CaO.B为Na2CO3. (3)碳酸化即向氨的饱和NaCl溶液中通入过量CO2.可析出NaHCO3晶体.反应中由于Na2CO3的溶解度大于NaHCO3的溶解度.因此不会析出Na2CO3晶体. (4)过滤除去NaHCO3.滤液D的主要成分为NH4Cl.要检验Cl-应选用AgNO3溶液和稀硝酸. (5)NH4Cl溶液与石灰水的反应为NH+OH-NH3↑+H2O. (6)设加热前固体质量为m1.加热后剩余固体质量为m2.样品中NaHCO3质量为m. 2NaHCO3Na2CO3+H2O+CO2↑ Δm 168 106 62 m m1-m2 则m=(m1-m2) w(NaHCO3)==. 答案:2或CaO Na2CO3 (2)溶解 过滤 蒸发 过滤 (3)有晶体析出 碳酸钠溶解度比碳酸氢钠大 (4)NH4Cl 取样.加硝酸酸化.加硝酸银.有白色沉淀.该阴离子是氯离子 (5)NH+OH-―→NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀 (6)wNaHCO3=(加热前的质量为m1.加热后为m2 )
网址:http://m.1010jiajiao.com/timu3_id_85120[举报]
(2011?南开区二模)工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.
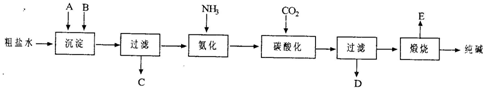
请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):
.
查看习题详情和答案>>

请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、
溶解
溶解
、沉淀、过滤、蒸发
蒸发
、冷却结晶、过滤、烘干.若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
液面高于滤纸边缘或滤纸破了
液面高于滤纸边缘或滤纸破了
.(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要
托盘天平、烧杯、500ml的容量瓶、胶头滴管
托盘天平、烧杯、500ml的容量瓶、胶头滴管
(填仪器名称).(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是
NaHCO3的溶解度小于Na2CO3
NaHCO3的溶解度小于Na2CO3
.碳酸化后过滤,滤液D最主要的成分是(写化学式)NH4Cl
NH4Cl
,检验这一部分的阴离子的具体方法是取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
取少量滤液,先加硝酸酸化,再滴加硝酸银溶液,有白色沉淀,该阴离子是氯离子;
.(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):
| 84(m1-m2) |
| 31m1 |
| 84(m1-m2) |
| 31m1 |
工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.

请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______.
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):______.
查看习题详情和答案>>
工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.
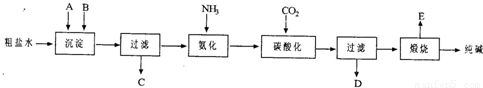
请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______ NH3↑+H2O 查看习题详情和答案>>

请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______ NH3↑+H2O 查看习题详情和答案>>
工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.
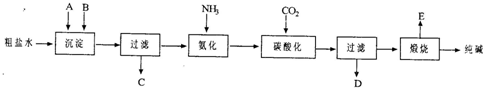
请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______.
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):______.
查看习题详情和答案>>

请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、过滤、______、冷却结晶、过滤、烘干.
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:______.
(2)实验室中,用提纯得到的NaCl配制500mL 1.00mol.L-1NaCl溶液,使用的仪器除药匙、玻璃棒、量筒外,还需要______(填仪器名称).
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是______.碳酸化后过滤,滤液D最主要的成分是(写化学式)______,检验这一部分的阴离子的具体方法是______.
(4)本工艺流程中氨是循环使用的,为此,向滤液D中加入石灰水产生氨.写出该反应的离子方程式______.
(5)产品纯碱中含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(请注明你的表达式中所用的有关符号的含义):______.
工业生产纯碱的工艺流程示意图如下:
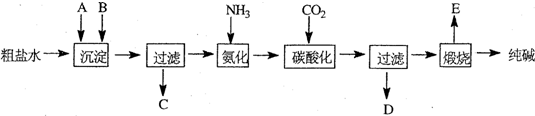
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式.
A 、B .
(2)碳酸化后发生反应的化学方程式是 .
(3)向母液 (选填图中字母)中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 .
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是 .
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为 .
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱.反应的化学方程式为 (已知产物之一为CaS).
查看习题详情和答案>>

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式.
A
(2)碳酸化后发生反应的化学方程式是
(3)向母液
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱.反应的化学方程式为