摘要:1. 工业合成氨的反应原理
网址:http://m.1010jiajiao.com/timu3_id_82248[举报]
合成氨的反应原理为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为

(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,
②用相同浓度的盐酸中和两种溶液至中性,
③加水稀释两种溶液至pH为10,
查看习题详情和答案>>
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是
AD
AD
(填序号).A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为
33.3%
33.3%
;该条件下反应的平衡常数为0.5
0.5
.
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,
B
B
中水的电离程度大.(填序号,下同)②用相同浓度的盐酸中和两种溶液至中性,
A
A
消耗的盐酸多.③加水稀释两种溶液至pH为10,
A
A
加入的水的体积大.合成氨的反应原理为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
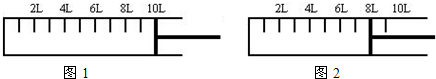
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
查看习题详情和答案>>
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
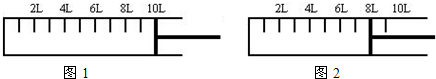
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
合成氨的反应原理为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
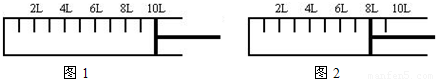
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
查看习题详情和答案>>
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
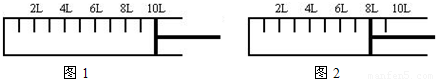
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
查看习题详情和答案>>
工业合成氨与制备硝酸一般可连续生产,流程如下
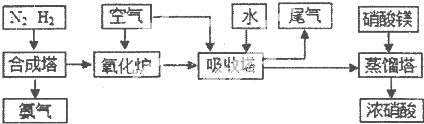
(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率图1所示.温度高于900℃时,NH3产率下降,原因是
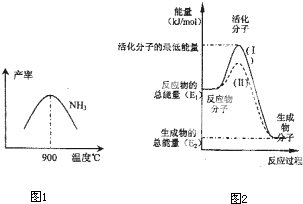
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
O2(g)=H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能为
(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
查看习题详情和答案>>

(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
0.18mol/L
0.18mol/L
转化率为40%
40%
该温度下此反应的平衡常数K=1
1
(填计算结果).②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
A
A
(选填A、B、C、D、E)| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
<
<
300℃(填“>”、“<”或“=”).| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
900℃时反应达到平衡状态,再升高温度平衡向左移动
900℃时反应达到平衡状态,再升高温度平衡向左移动
.
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
放热
放热
(填“吸热”或“放热”)反应,该反应的△H=-(E1-E2)kJ/mol
-(E1-E2)kJ/mol
(用含E1、E2E的代数式表示).已知热化学方程式:H2(g)+| 1 |
| 2 |
409kJ/mol
409kJ/mol
.(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
.工业合成氨与制备硝酸一般可连续生产,流程如下:
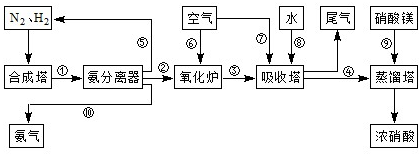
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中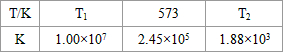
T1
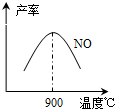 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
查看习题详情和答案>>

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
1
1
(填计算结果).②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=
50%
50%
.(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中

T1
<
<
573K(填“>”、“<”或“=”). (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因温度高于900℃时,平衡向左移动
温度高于900℃时,平衡向左移动
.(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
5×10-7
5×10-7
mol/L.(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
.与方法一相比,方法二的优点为能同时除去废水中的氮,充分利用了镁矿工业废水
能同时除去废水中的氮,充分利用了镁矿工业废水
.