摘要:10.(2010·山东省实验中学1月考题)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知: ①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g),ΔH1=+64.39 kJ·mol-1 ②2H2O2(l)===2H2O(l)+O2(g),ΔH2=-196.46 kJ·mol-1 ③H2(g)+1/2O2(g)===H2O(l),ΔH3=-285.84 kJ·mol-1 在H2SO4溶液中.Cu与H2O2反应生成Cu2+和H2O的热化学方程式可以表示为( ) A.Cu+H2O2+2H+===Cu2++2H2O,ΔH=-319.68 kJ·mol-1 B.Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l),ΔH=-319.68 kJ·mol-1 C.1/2Cu(s)+1/2H2O2(l)+H+(aq)===1/2Cu2+(aq)+H2O(l),ΔH=+319.68 kJ·mol-1 D.Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l),ΔH=-419.68 kJ·mol-1 解析:热化学方程式正误判断方法:一看是否配平.二看是否标明物质的状态.三看能量变化是否与计量数相对应.即ΔH与反应物的物质的量是否对应.三者缺一不可.根据盖斯定律.①+×②+③得:Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l),ΔH=ΔH1+1/2ΔH2+ΔH3=-319.68 kJ·mol-1. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_80994[举报]
(2011?黄山模拟)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
(1)X位于元素周期表第
(2)X与Y中电负性较强的是(填元素符号)
 ,分子中存在
,分子中存在
(3)Z2Y2中含有的化学键类型有
(4)W的基态原子核外电子排布式是
(5)废旧印刷电路板上有W的单质A.用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A.已知:
A(s)+H2SO4(aq)═ASO4(aq)+H2(g)△H=+64.4kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
查看习题详情和答案>>
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 原子最外层电子数是次外层的三倍 |
| Z | 单质及其化合物的焰色反应为黄色 |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
ⅣA
ⅣA
族.X的一种单质熔点很高,硬度很大,则这种单质的晶体属于原子
原子
晶体.(2)X与Y中电负性较强的是(填元素符号)
O
O
;XY2的电子式是

2
2
个σ键.(3)Z2Y2中含有的化学键类型有
离子键和非极性键
离子键和非极性键
.阴、阳离子的个数比为1:2
1:2
.(4)W的基态原子核外电子排布式是
1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
.(5)废旧印刷电路板上有W的单质A.用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A.已知:
A(s)+H2SO4(aq)═ASO4(aq)+H2(g)△H=+64.4kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.4kJ?mol-1
H2(g)+
| 1 |
| 2 |
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
Cu (s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O (l)△H=-319.6 kJ/mol
Cu (s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O (l)△H=-319.6 kJ/mol
.(2010?潮州二模)过氧化氢是重要的氧化剂、还原剂,其水溶液又称双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量,并探究过氧化氢的性质、用途.
Ⅰ.测定过氧化氢的含量
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL 容量瓶中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
.
(3)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
Ⅱ.探究过氧化氢的性质
(4)该化学兴趣小组根据所提供的实验条件设计了两个实验,分别验证过氧化氢的氧化性和不稳定性.(实验试剂只有:过氧化氢溶液、稀硫酸、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选.)请填写他们的实验方法和实验现象的表中空白:
Ⅲ.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜
(5)印刷电路板金属粉末中的Cu在H2SO4与H2O2溶液中反应生成Cu2+和H2O的离子方程式为
(6)控制其他条件相同,印刷电路板的Cu用10%H2O2和3.0mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率如下表:
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
查看习题详情和答案>>
Ⅰ.测定过氧化氢的含量
(1)移取10.00mL密度为ρ g/mL的过氧化氢溶液至250mL 容量瓶中,加水稀释至刻度,摇匀.移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
| 17Cv |
| 200ρ |
| 17Cv |
| 200ρ |
(3)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
偏高
偏高
(填“偏高”或“偏低”或“不变”).Ⅱ.探究过氧化氢的性质
(4)该化学兴趣小组根据所提供的实验条件设计了两个实验,分别验证过氧化氢的氧化性和不稳定性.(实验试剂只有:过氧化氢溶液、稀硫酸、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选.)请填写他们的实验方法和实验现象的表中空白:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | 取适量碘化钾淀粉溶液、稀硫酸于试管中,滴入过氧化氢溶液.(或:取适量饱和硫化氢溶液于试管中,滴入过氧化氢溶液.) | 溶液变蓝色 溶液变蓝色 .(或: 产生淡黄色沉淀或溶液变浑浊 产生淡黄色沉淀或溶液变浑浊 ) |
| 验证热不稳定性 | 取适量过氧化氢溶液于试管中, 稍微加热 稍微加热 用带火星的木条检验 用带火星的木条检验 . |
产生气泡,带火星的木条复燃. |
(5)印刷电路板金属粉末中的Cu在H2SO4与H2O2溶液中反应生成Cu2+和H2O的离子方程式为
Cu+H2O2+2H+=Cu2++2H2O
Cu+H2O2+2H+=Cu2++2H2O
.(6)控制其他条件相同,印刷电路板的Cu用10%H2O2和3.0mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
温度升高,H2O2分解速率加快
温度升高,H2O2分解速率加快
.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=-285.84kJ?mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热方程式为 .
查看习题详情和答案>>
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39kJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ?mol-1
H2(g)+
| 1 | 2 |
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热方程式为
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol?L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是
查看习题详情和答案>>
(1)写出工业上制备印刷电路板原理的离子方程式:
Cu+2Fe3+=Cu2++2Fe2+
Cu+2Fe3+=Cu2++2Fe2+
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
BD
BD
(填字母).A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式
Cu+H2O2+2H+=Cu2++2H2O
Cu+H2O2+2H+=Cu2++2H2O
.(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol?L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3 mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
H2O2分解速率加快
H2O2分解速率加快
.(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
| ||
2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+
.
| ||
写出下列反应的热化学方程式.
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
H2(g)+
O2(g)=H2O(l)△H=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 (填序号)
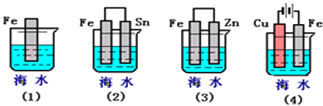 查看习题详情和答案>>
查看习题详情和答案>>
(1)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧生成1molSO2的热化学方程式
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
H2(g)+
| 1 | 2 |
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
 查看习题详情和答案>>
查看习题详情和答案>>