网址:http://m.1010jiajiao.com/timu3_id_80857[举报]
已知下列热化学方程式:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
Fe2O3(s)+ 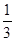 CO(g)
CO(g)
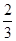 Fe3O4(s)+
Fe3O4(s)+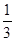 CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/mol
Fe3O4(s)+ CO(g) 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
 2Fe(s)+3CO2(g);△H="-24.8" kJ/mol
2Fe(s)+3CO2(g);△H="-24.8" kJ/molFe2O3(s)+
 CO(g)
CO(g)
 Fe3O4(s)+
Fe3O4(s)+ CO2(g);△H="-15.73" kJ/mol
CO2(g);△H="-15.73" kJ/molFe3O4(s)+ CO(g)
 3FeO(s)+CO2(g);△H="+640.4" kJ/mol
3FeO(s)+CO2(g);△H="+640.4" kJ/mol则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为 ( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |
已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g);ΔH=-25 kJ/mol
2Fe(s)+3CO2(g);ΔH=-25 kJ/mol
(2)3Fe2O3(s)+CO(g)![]() 2Fe3O4(s)+CO2(g);ΔH=-47 kJ/mol
2Fe3O4(s)+CO2(g);ΔH=-47 kJ/mol
(3)Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g);ΔH=+19 kJ/mol
3FeO(s)+CO2(g);ΔH=+19 kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式________.
(3分)已知下列热化学方程式
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ/mol
3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ/mol
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式:
查看习题详情和答案>>
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(3)下列关于反应①的说法正确的是 。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。 查看习题详情和答案>>