网址:http://m.1010jiajiao.com/timu3_id_80451[举报]
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
①________;②________;③________;④________。
(2)在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)
与所加盐酸的体积关系如图所示:
①分别加入足量的盐酸后的溶液中的溶质是________,原NaOH溶液的物质的量浓度为________。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为________,其物质的量之比为________。
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
①________;②________;③________;④________。
(2)在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)
与所加盐酸的体积关系如图所示:

①分别加入足量的盐酸后的溶液中的溶质是________,原NaOH溶液的物质的量浓度为________。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为________,其物质的量之比为________。
查看习题详情和答案>>
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
① ;② ;③ ;④ 。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。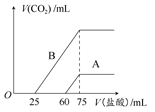
①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。
②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是:
① ;② ;③ ;④ 。
(2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
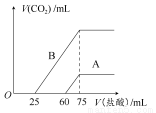
①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。
②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。
③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。
查看习题详情和答案>>
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
①________;②________;③________;④________。
(2)在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)
与所加盐酸的体积关系如图所示:

①分别加入足量的盐酸后的溶液中的溶质是________,原NaOH溶液的物质的量浓度为________。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为________,其物质的量之比为________。