网址:http://m.1010jiajiao.com/timu3_id_80205[举报]
 A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).
A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:
已知:A、B、D均是有机物,其中A、B是家庭厨房中常用调味品的主要成分,且B的相对分子质量比A大14,E是密度最小的气体,则F为
 CH3COOC2H5+H2O
CH3COOC2H5+H2O CH3COOC2H5+H2O
CH3COOC2H5+H2OA、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:
①A、B、E能使湿润的蓝色石蕊试纸变红,F能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色。
②A和F相遇产生白烟。
③B和E都能使品红溶液褪色。
④将红热的铜丝放入装有B的集气瓶中,瓶内充满棕黄色的烟。
⑤C和D相遇生成红棕色气体,且D可助燃。
⑥G是常见的半导体材料
回答下列问题:
(1)A的化学式是 ,②中的白烟是 (填化学式)。
(2)④中发生反应的化学方程式是
(3)C的化学式是 ,E的化学式是
(4)写出工业上制G的化学方程式
(5)B是一种有毒气体,实验室可用 吸收B,反应的离子方程式是
写出实验室制取B的化学方程式
查看习题详情和答案>>A、B、C、D、E、F是中学化学中常见的气体,G是一种固体非金属单质,它们具有如下的性质:
①A、B、E能使湿润的蓝色石蕊试纸变红,F能使湿润的红色石蕊试纸变蓝,C、D不能使湿润的石蕊试纸变色。
②A和F相遇产生白烟。
③B和E都能使品红溶液褪色。
④将红热的铜丝放入装有B的集气瓶中,瓶内充满棕黄色的烟。
⑤C和D相遇生成红棕色气体,且D可助燃。
⑥G是常见的半导体材料
回答下列问题:
(1)A的化学式是 ,②中的白烟是 (填化学式)。
(2)④中发生反应的化学方程式是
(3)C的化学式是 ,E的化学式是
(4)写出工业上制G的化学方程式
(5)B是一种有毒气体,实验室可用 吸收B,反应的离子方程式是
写出实验室制取B的化学方程式
A、B、C、D、E、F是中学化学中常见的无色气体,它们均由短周期元素组成。A、B、C相互转化关系如图所示(部分产物已略去)。
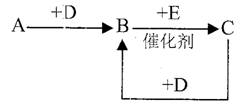
①A能使湿润的红色石蕊试纸变蓝;C、D为空气中的主要成分;B、E是有毒气体,它们的分子均由同周期元素原子构成。
②B和D相遇生成红棕色气体。
③F是形成酸雨的一种有害气体,有刺激性气味。
回答下列问题:
(1)C的电子式是 。
(2)写出A→B的化学方程式 。
(3)B和E发生反应的化学方程式是 。
(4)常温下,把一定量的A通入水中,测得溶液的pH=12,则该溶液中由水电离出的OH—浓度为 ;该溶液中,一定能大量共存的离子组是 (填序号)。
a.Na+ NO—3 Fe2+ C1— b.Ag+ Mg2+ Ca2+ NO—3
c.Al3+ K+ A1O—3 C1— d.CO2-3 Na+ K+ NO—3
(5)简述实验室验证F存在的方法 。
查看习题详情和答案>>
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题: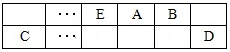
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。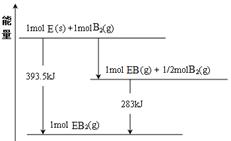
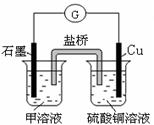
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。