网址:http://m.1010jiajiao.com/timu3_id_79783[举报]
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于
(2)当n=2时,B与C形成的晶体属于
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是
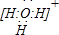
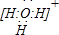
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为


(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程


(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
(6)请写出Z的原子核外电子排布式
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:

(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______???????????? __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;?
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为??????????????????? 。
(2)丙的电子式为??????????? 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是??????????? 。
A.KCl??????????? B.KOH?????????? C.Na2S????????????? D.CuO
查看习题详情和答案>>
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:
(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______ __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为 。
(2)丙的电子式为 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A.KCl B.KOH C.Na2S D.CuO
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于______键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是______;
(2)当n=2时,B与C形成的晶体属于______晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为______,微粒间的作用力是______;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物.
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为______,与CO互为等电子体的离子为______(填化学式).
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是______,Ga的第一电离能却明显低于Zn,原因是______.
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是______.
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
查看习题详情和答案>>