网址:http://m.1010jiajiao.com/timu3_id_79475[举报]
某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设③设计另一实验方案如下:

(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
查看习题详情和答案>>
某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下: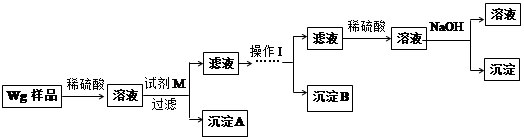
乙同学同样基于假设③设计另一实验方案如下: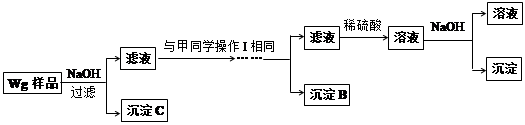
(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设③设计另一实验方案如下:

(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=
(2)室温下取0.2mol?L-1HCl溶液与0.2mol?L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中水电离出的c(H+)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=
(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
实验编号 | HCl物质的量浓度(mol·L-1) | BOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | 0.2 | c1 | pH=7 |
丙 | 0.1 | 0.2 | pH<7 |
丁 | 0.1 | 0.1 | pH=5 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明BOH是强碱还是弱碱_____________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1____________(选填“是”或“否”)。混合溶液中离子浓度c(B+)与c(Cl-)的大小关系是____________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,BOH是____________酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是____________。
(4)丁组实验所得混合溶液中由水电离出的c(H+)=____________mol·L-1。
写出该混合溶液中下列精确算式(不能做近似计算)。
c(Cl-)-c(B+)=________________________mol·L-1
c(H+)-c(BOH)=________________________mol·L-1