摘要:18.已知可逆反应:M P,ΔH>0.请回答下列问题: (1)某温度下.反应物的起始浓度分别为:c(M)=1 mol/L.c(N)=2.4 mol/L,达到平衡后.M的转化率为60%.此时N的转化率为 , (2)若反应温度升高.M的转化率 (填“增大 “减小 或“不变 ), (3)若反应温度不变.反应物的起始浓度分别为:c(M)=4 mol/L.c(N)=a mol/L,达到平衡后.c(P)=2 mol/L.a= , (4)若反应温度不变.反应物的起始浓度为:c(M)=c(N)=b mol/L.达到平衡后.M的转化率为 . 解析:P 始态 1 mol/L 2.4 mol/L 0 0 变化量 1 mol/L×60% 1 mol/L×60% 因此N的转化率为:×100%=25% (2)由于该反应的ΔH>0.即正反应为吸热反应.因此升高温度.平衡右移.M的转化率增大. 可求出各平衡浓度: c(M)=0.4 mol/L c(N)=1.8 mol/L.c(P)=0.6 mol/L c(Q)=0.6 mol/L 因此化学平衡常数K=== 由于温度不变.因此K不变.达到平衡后 c(P)=2 mol/L c(Q)=2 mol/L.c(M)=2 mol/L c(N)=(a-2)mol·L-1 k=== 解得a=6 (4)设M的转化率为x.则达到平衡后各物质的平衡浓度分别为: c(M)=b(1-x)mol/L c(N)=b(1-x)mol/L.c(P)=bx mol/L c(Q)=bx mol/L K===.解得x=41% 答案:6 (4)41% 19.在A+B 2C的反应中.在某温度下经t s后混合物中C 的百分含量的变化情况如右图所示.则 (1)A与B化合生成C的反应是 热反应. (2)温度在475℃以下.随温度升高.C的百分含量增大.这是因为 . (3)当温度在475℃以上.随温度升高.C的百分含量反而减小.这是因为 . (4)当温度在475℃时.若B为气态.体系加压时.C的浓度不变.则A.C的状态又如何? 解析:(1)据图象分析:随着温度升高.C%反而降低.故本反应是放热反应. (2)在475℃以下.是建立平衡阶段.v.所以C%增大. (3)在475℃以上.是因为达平衡后.升温向左移动.v.所以生成物的含量反而 减小. 答案:建立平衡阶段.v.所以C%增大 (3)升温平衡向左移动. v.所以生成物的含量反而减小 (4)A.C均为气态或C为固(液)态
网址:http://m.1010jiajiao.com/timu3_id_78966[举报]
(2008?宁夏)已知可逆反应:M(g)+N(g)?P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
(2)若反应温度升高,M的转化率
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol?L-1,达到平衡后,M的转化率为
查看习题详情和答案>>
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.(2)若反应温度升高,M的转化率
增大
增大
(填“增大”、“减小”或“不变”)(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
6
6
.(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol?L-1,达到平衡后,M的转化率为
41%
41%
.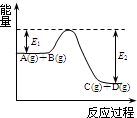 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.①该反应是
放热
放热
反应(填“吸热”“放热”);②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小”“不变”);(2)已知可逆反应:M(g)+N(g)
 P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
BCF
BCF
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
25%
25%
.③若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2mol?L-1,a=
6
6
mol?L-1.已知可逆反应:M(g)+N(g)?P(g)+Q(g);△H<0.请回答下列问题:
(1)在此温度下,反应物的起始浓度分别为:c(M)=1mol/L,c(N)=2mol/L;达平衡后,M的转化率为50%,求N的转化率
(2)若升高温度,M的转化率
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=3mol/L,c(N)=a mol/L,达平衡后,c(P)=2mol/L.求a=
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L.达平衡后 M的转化率为
查看习题详情和答案>>
(1)在此温度下,反应物的起始浓度分别为:c(M)=1mol/L,c(N)=2mol/L;达平衡后,M的转化率为50%,求N的转化率
25%
25%
;(2)若升高温度,M的转化率
减小
减小
(填增大 减小 不变)(3)若反应温度不变,反应物的起始浓度分别为:c(M)=3mol/L,c(N)=a mol/L,达平衡后,c(P)=2mol/L.求a=
14
14
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L.达平衡后 M的转化率为
36.6%
36.6%
.