摘要:15.(2010年北京市宣武区质检)由C.Cu.FeCO3.铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物.进行了如下所示的实验过程: 回答下列问题: (1)无色气体1的成分是: . (2)混合物乙中加入NaNO3后.反应的离子方程式是: . (3)溶液X中含有的金属阳离子是 . (4)无色气体3的成分是: :检验无色气体3成分的实验方案是: . [解析] 第一步两种碳酸盐与稀H2SO4反应.产生CO2气体.加入NaNO3后相当于Fe2+.Cu与稀HNO3反应.过滤后固体混合物主要为C.与浓H2SO4反应产生CO2和SO2. [答案] (1)CO2 (2)NO 3Cu+2NO+8H+===3Cu2++2NO↑+4H2O 3Fe2++NO+4H+===3Fe3++NO↑+2H2O Cu+2Fe3+===Cu2++2Fe2+ (3)Cu2+.Fe2+.Na+ (4)CO2.SO2 将无色气体3通入Br2水中.若Br2水颜色变浅证明有SO2,再将逸出的气体通入石灰水中.若有白色沉淀.则有CO2
网址:http://m.1010jiajiao.com/timu3_id_77702[举报]
由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程:

回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,反应的离子方程式是:
。
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3的成分是: ;检验无色气体3成分的实验方案是:
。
查看习题详情和答案>>从物质A开始有如图所示的转化关系(其中部分产物已略去).已知1molF与足量的新制Cu(OH)2在加热条件下充分反应可生成2mol红色沉淀.分析并回答问题.

(1)A中含有的官能团的化学式为
(2)写出下列物质的结构简式B
 ;
;
(3)指出反应类型:E→M
(4)写出E→H反应的化学方程式
 .
.
(5)已知一个碳原子上有两个羟基为不稳定结构,与C含有相同种类及数目的官能团的同分异构体共有
(6)由C的一种同分异构体I制有机玻璃 的过程如下:
的过程如下:

写出下列物质的结构简式:Ⅰ
查看习题详情和答案>>

(1)A中含有的官能团的化学式为
-COOC-、-OH、-Cl
-COOC-、-OH、-Cl
;(2)写出下列物质的结构简式B
HOCH2CH2COONa
HOCH2CH2COONa
C

(3)指出反应类型:E→M
酯化反应
酯化反应
H→I加聚反应
加聚反应
;(4)写出E→H反应的化学方程式


(5)已知一个碳原子上有两个羟基为不稳定结构,与C含有相同种类及数目的官能团的同分异构体共有
5
5
种(稳定结构,不包括C)(6)由C的一种同分异构体I制有机玻璃
 的过程如下:
的过程如下:
写出下列物质的结构简式:Ⅰ
(CH3)2C(OH)CH2OH
(CH3)2C(OH)CH2OH
Ⅱ(CH3)2C(OH)COOH
(CH3)2C(OH)COOH
ⅢCH2=C(CH3)COOH
CH2=C(CH3)COOH
.由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1mol B离子与1mol E离子作用可生成2mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解.
(1)微粒A的化学式是
(2)写出F与过量C溶液反应的离子方程式:
(3)写出由C的水溶液制[Cu(NH3)4]SO4?H2O晶体的两个主要离子反应方程式:
查看习题详情和答案>>
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1mol B离子与1mol E离子作用可生成2mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解.
(1)微粒A的化学式是
NH4+
NH4+
;微粒E的名称是水合氢离子
水合氢离子
.构成微粒F的元素在元素周期表中的位置是第三周期、ⅢA族
第三周期、ⅢA族
.(2)写出F与过量C溶液反应的离子方程式:
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(3)写出由C的水溶液制[Cu(NH3)4]SO4?H2O晶体的两个主要离子反应方程式:
Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
.(2013?重庆模拟)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物(两者都不含结晶水).
Ⅰ.按照乙同学的观点,你认为其原理是
Ⅱ.将上述产生的蓝色沉淀洗涤、干燥后放入试管中加热,定性探究生成物的成分.
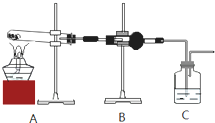
(1)B装置中试剂的化学式是
(2)能证明乙同学观点正确的实验现象是
Ⅲ.研究性学习小组的同学为了测定一包由CuCO3和Cu(OH)2组成的混合物中Cu(OH)2的质量分数,设计出下列装置进行实验.
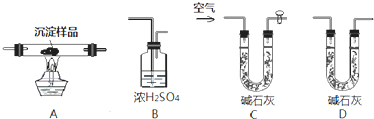
(1)各装置连接的顺序为
(2)实验开始和结束时都要通入过量的空气,结束时通入过量空气的作用是
(3)若沉淀样品的质量为m g,装置D质量增加了n g,则其中Cu(OH)2的质量分数为
%
%.
(4)利用上述装置测出的Cu(OH)2质量分数偏低,其原因是
查看习题详情和答案>>
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物(两者都不含结晶水).
Ⅰ.按照乙同学的观点,你认为其原理是
Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(用离子方程式表示).Ⅱ.将上述产生的蓝色沉淀洗涤、干燥后放入试管中加热,定性探究生成物的成分.

(1)B装置中试剂的化学式是
CuSO4
CuSO4
,C装置中试剂的名称是澄清石灰水
澄清石灰水
;(2)能证明乙同学观点正确的实验现象是
B中白色固体变为蓝色,C中澄清石灰水不变浑浊
B中白色固体变为蓝色,C中澄清石灰水不变浑浊
.Ⅲ.研究性学习小组的同学为了测定一包由CuCO3和Cu(OH)2组成的混合物中Cu(OH)2的质量分数,设计出下列装置进行实验.

(1)各装置连接的顺序为
CABD
CABD
;(2)实验开始和结束时都要通入过量的空气,结束时通入过量空气的作用是
可以将装置中滞留的水蒸气和二氧化碳赶出
可以将装置中滞留的水蒸气和二氧化碳赶出
;(3)若沉淀样品的质量为m g,装置D质量增加了n g,则其中Cu(OH)2的质量分数为
| 100(11m-31n) |
| 11m |
| 100(11m-31n) |
| 11m |
(4)利用上述装置测出的Cu(OH)2质量分数偏低,其原因是
空气中的水蒸气和二氧化碳被装置D中的碱石灰吸收
空气中的水蒸气和二氧化碳被装置D中的碱石灰吸收
.已知两个羧基在浓 H2SO4 作用下脱去一个水分子生成酸酐,如图1:
(如图2)某酯类化合物A是广泛使用的塑料增塑剂.A在酸性条件下能够生成B、C、D.
(1)已知C仅由C、H、O三种元素组成.其分子量不超过200,其中含氧元素58.3%.则C的分子式为
(2)已知C不能被CuO氧化,与氯气反应后的一氯代物只有一种,1mol的C分别与钠和碳酸氢钠反应生成气体为2mol 和3mol,则C中官能团名称
(3)C和D与浓硫酸共热能发生酯化反应,可生成
(4)已知F为C发生分子内脱水后的产物.
①若F与氯气反应后的一氯代物只有一种,则F的结构简式为
 .
.
②若C→F为消去反应,写出反应的化学方程式
 +H2O
+H2O
 +H2O.
+H2O.
(5)写出下列反应的化学方程式:
①G与新制Cu(OH)2反应:
②A与足量NaOH溶液共热: +4NaOH
+4NaOH
 +CH3COONa+4H2O+4CH3CH2CH2CH2OH
+CH3COONa+4H2O+4CH3CH2CH2CH2OH +4NaOH
+4NaOH
 +CH3COONa+4H2O+4CH3CH2CH2CH2OH.
+CH3COONa+4H2O+4CH3CH2CH2CH2OH.
查看习题详情和答案>>

(如图2)某酯类化合物A是广泛使用的塑料增塑剂.A在酸性条件下能够生成B、C、D.
(1)已知C仅由C、H、O三种元素组成.其分子量不超过200,其中含氧元素58.3%.则C的分子式为
C6H8O7
C6H8O7
.(2)已知C不能被CuO氧化,与氯气反应后的一氯代物只有一种,1mol的C分别与钠和碳酸氢钠反应生成气体为2mol 和3mol,则C中官能团名称
羧基、羟基
羧基、羟基
.(3)C和D与浓硫酸共热能发生酯化反应,可生成
5
5
种酯类化合物.(4)已知F为C发生分子内脱水后的产物.
①若F与氯气反应后的一氯代物只有一种,则F的结构简式为


②若C→F为消去反应,写出反应的化学方程式

| 浓H2SO4 |
| △ |
 +H2O
+H2O
| 浓H2SO4 |
| △ |
 +H2O
+H2O(5)写出下列反应的化学方程式:
①G与新制Cu(OH)2反应:
CH3CH2CH2CHO+2Cu(OH)2
CH3CH2CH2COOH+Cu2O+2H2O
| △ |
CH3CH2CH2CHO+2Cu(OH)2
CH3CH2CH2COOH+Cu2O+2H2O
;| △ |
②A与足量NaOH溶液共热:
 +4NaOH
+4NaOH| △ |
 +CH3COONa+4H2O+4CH3CH2CH2CH2OH
+CH3COONa+4H2O+4CH3CH2CH2CH2OH +4NaOH
+4NaOH| △ |
 +CH3COONa+4H2O+4CH3CH2CH2CH2OH
+CH3COONa+4H2O+4CH3CH2CH2CH2OH