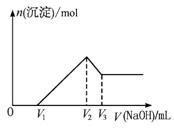
摘要:将m g Al2O3和Fe2O3的混合物溶于100 mL盐酸中.然后逐滴加入1 mol·L-1 NaOH溶液.其结果如图11-1所示. 图11-1 (1)最初加入V1 mL NaOH溶液的作用是 . (2)盐酸的物质的量浓度是 . (3)若m g混合物中Al2O3与Fe2O3按不同比例进行上述实验.则V2的值改变 .(V2-V1)的取值范围是 . 解析:这是一道涉及铝图象计算题.从图中看出氢氧化钠溶液体积0-V1时.无沉淀.故中和的是过量的盐酸.V1-V2氢氧根离子与Al3+.Fe3+结合形成沉淀.当在V2时沉淀完全.此时溶液中只有氯化钠.即盐酸的物质的量与氢氧化钠的物质的量相等.可借此求得盐酸的浓度.又可确定V2的值只与盐酸的用量有关.而与Al2O3.Fe2O3相对量无关.问题(3)求V2-V1的取值范围.这一段是沉淀Al3+.Fe3+.每摩离子均只消耗3 mol氢氧化钠.可利用极限法:若只含Al2O3.则Al3+物质的量为m/51 mol,若只含Fe2O3.则Fe3+物质的量为m/80 mol.从而确定氢氧化钠的物质的量及取值范围. 答案:V2×10-2 mol·L-1 (3)不会 3m/80×103<(V2-V1)<m/17×103
网址:http://m.1010jiajiao.com/timu3_id_76520[举报]
将m g Al2O3和Fe2O3的混合物溶于100 mL盐酸中,然后逐滴加入1 mol·L-1 NaOH溶液,其结果如图11-1所示。
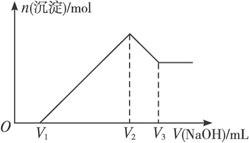
图11-1
(1)最初加入V1 mL NaOH溶液的作用是__________________________________________。
(2)盐酸的物质的量浓度是___________________________。
(3)若m g混合物中Al2O3与Fe2O3按不同比例进行上述实验(其他条件不变),则V2的值改变________(填“会”或“不会”),(V2-V1)的取值范围是_________________________。
查看习题详情和答案>>