摘要:20.某研究性学习小组对铝热反应实验进行研究.“铝热反应 的现象是“反应放出大量的热.并发出耀眼的光芒 和“纸漏斗的下部被烧穿.有熔融物落入沙中 . 查阅可知.Al.Fe2O3.Al2O3.Fe的熔.沸点数据如下: 物质 Al Fe2O3 Al2O3 Fe 熔点(℃) 660 1 462 2 054 1 535 沸点(℃) 2 467 - 2 980 2 750 (1)某同学推测.铝热反应所得到的熔融物质是铁铝合金.理由是:该反应放热.能使铁熔化.而铝的熔点比铁低.此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理? . (2)设计一个简单的实验方案.证明上述所得的块状熔融物中含有金属铝.填写下列表格: 所用试剂 实验操作及现象 有关反应的化学方程式 (3)实验室欲溶解此熔融物.下列试剂中最好的是 . A.浓硫酸 B.稀硫酸 C.稀硝酸 D.NaOH溶液 答案:(1)合理 (2) 所用试剂 氢氧化钠溶液 实验操作及现象 取适量块状熔融物置于试管中.加入氢氧化钠溶液.有气体产生 有关反应的化学方程式 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ (3)B
网址:http://m.1010jiajiao.com/timu3_id_75458[举报]
某研究性学习小组对铝热反应实验进行研究,“铝热反应”的现象是“反应放出大量的热,并发出耀眼的光芒”和“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》可知,Al、Fe2O3、Al2O3、Fe的熔、沸点数据如下:
| 物质 | Al | Fe2O3 | Al2O3 | Fe |
| 熔点(℃) | 660 | 1 462 | 2 054 | 1 535 |
| 沸点(℃) | 2 467 | — | 2 980 | 2 750 |
(1)某同学推测,铝热反应所得到的熔融物质是铁铝合金。理由是:该反应放热,能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?__________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。填写下列表格:
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
(3)实验室欲溶解此熔融物,下列试剂中最好的是__________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.NaOH溶液
查看习题详情和答案>>某研究性学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究.已知Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表所示:
试回答下列问题:
(1)铝热反应是氧化还原反应,在反应中金属铝表现出
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是
②该同学的实验方案是否合理?答:
(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol?L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mol?L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和
②n的取值范围是
③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为
查看习题详情和答案>>
| 物质 | Al | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ---- |
(1)铝热反应是氧化还原反应,在反应中金属铝表现出
还原
还原
性 (填“氧化”或“还原”).(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为
氢氧化钠溶液
氢氧化钠溶液
,可观察到的实验现象是溶液中有气泡出现
溶液中有气泡出现
.(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是
KSCN
KSCN
(填化学式).②该同学的实验方案是否合理?答:
不合理
不合理
(填“合理”或“不合理”).(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol?L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mol?L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和
玻璃棒
玻璃棒
、胶头滴管
胶头滴管
.②n的取值范围是
0<n<0.84
0<n<0.84
.③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为
2
2
mol.某研究性学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究.已知Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表所示:
试回答下列问题:
(1)铝热反应是氧化还原反应,在反应中金属铝表现出______性 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为______,可观察到的实验现象是______.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是______ (填化学式).
②该同学的实验方案是否合理?答:______ (填“合理”或“不合理”).
(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol-L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mo1-L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和______、______.
②n的取值范围是______.
③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为______ mol.
查看习题详情和答案>>
| 物质 | Al | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ---- |
(1)铝热反应是氧化还原反应,在反应中金属铝表现出______性 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为______,可观察到的实验现象是______.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是______ (填化学式).
②该同学的实验方案是否合理?答:______ (填“合理”或“不合理”).
(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol-L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mo1-L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和______、______.
②n的取值范围是______.
③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为______ mol.
某研究性学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究.已知Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表所示:
试回答下列问题:
(1)铝热反应是氧化还原反应,在反应中金属铝表现出______性 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为______,可观察到的实验现象是______.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是______ (填化学式).
②该同学的实验方案是否合理?答:______ (填“合理”或“不合理”).
(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol?L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mo1?L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和______、______.
②n的取值范围是______.
③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为______ mol.
查看习题详情和答案>>
| 物质 | Al | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ---- |
(1)铝热反应是氧化还原反应,在反应中金属铝表现出______性 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为______,可观察到的实验现象是______.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则
①物质甲是______ (填化学式).
②该同学的实验方案是否合理?答:______ (填“合理”或“不合理”).
(4)把l5.12g Fe、Fe2O3和Al的混合物与0.5L 2mol?L-1稀硫酸(足量)充分反应,生成氢气n mol.则
①用浓硫酸配制0.5L 2mo1?L-1的稀硫酸需要的玻璃仪器有烧杯、500mL容量瓶、量筒和______、______.
②n的取值范围是______.
③向反应后的混合溶液中滴加NaOH溶液,当产生沉淀的量达到最大时,参加反应的NaOH的物质的量为______ mol.
查看习题详情和答案>>
某研究性学习小组为探究铝与饱和氯化铜溶液的反应,设计实验探究方案如下:
(一)实验用品:纯铝片、饱和氯化铜溶液
(二)实验记录:
(三)背景资料:纳米铜粉呈紫色至黑色
(四)请你根据所学知识参与并完成该实验的以下探究、拓展及应用:
(1)在一段时间内气泡产生越来越快的主要原因是: (填写一个即可).
(2)该实验中有少量蓝色悬浊液和大量气体生成的原因是(用离子方程式表示): .
(3)该小组设计实验对反应进行一段时间后的混合液体进行分离、提纯,以得到纯净的AlCl3和CuCl2.实验步骤如图:
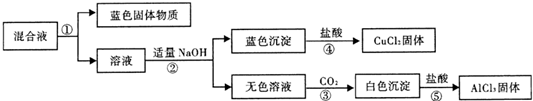
请你完成:
1)在①、②、③中进行的实验操作均相同,其名称是 .
2)操作②中生成无色溶液的化学方程式为 .
3)以下是操作④、⑤制取无水AlCl3和CuCl2固体的部分装置(铁架台、加热装置等已略去)
i.该装置如下图,装置a由 、圆底烧瓶、双孔塞和导管组成.
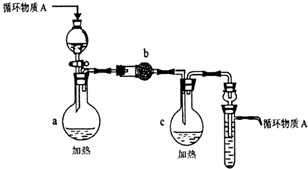
ii.无水AlCl3和CuCl2是在装置c中制得的,但需在氯化氢存在的条件下进行该操作,目的是 .
(4)请你选用中学化学中常用药品(试剂),填写下表,完成该小组探究反应过程中铝表面的黑色物质的实验方案.(提示:该小组同学猜想可能是Cu或CuO或两种混合物)
查看习题详情和答案>>
(一)实验用品:纯铝片、饱和氯化铜溶液
(二)实验记录:
| 1.将铝片放入饱和氯化铜溶液中,反应较快,浸在溶液中的铝片表面迅速生成蓬松的红色固体,同时在液面处的铝片以及有液体飞溅到上部的铝片表面有黑色物质生成.2.有大量气泡产生,在一段时间内产生气泡越来越快,将其收集并点燃发出爆鸣声.3.有少量蓝色悬浊液产生. |
(四)请你根据所学知识参与并完成该实验的以下探究、拓展及应用:
(1)在一段时间内气泡产生越来越快的主要原因是:
(2)该实验中有少量蓝色悬浊液和大量气体生成的原因是(用离子方程式表示):
(3)该小组设计实验对反应进行一段时间后的混合液体进行分离、提纯,以得到纯净的AlCl3和CuCl2.实验步骤如图:

请你完成:
1)在①、②、③中进行的实验操作均相同,其名称是
2)操作②中生成无色溶液的化学方程式为
3)以下是操作④、⑤制取无水AlCl3和CuCl2固体的部分装置(铁架台、加热装置等已略去)
i.该装置如下图,装置a由

ii.无水AlCl3和CuCl2是在装置c中制得的,但需在氯化氢存在的条件下进行该操作,目的是
(4)请你选用中学化学中常用药品(试剂),填写下表,完成该小组探究反应过程中铝表面的黑色物质的实验方案.(提示:该小组同学猜想可能是Cu或CuO或两种混合物)
| 预设验证方法 | 猜想的现象 | 结论 |
| 取适量覆盖有黑色物质的铝片于试管中, |
黑色物质含铜,可能是纳米铜 |