网址:http://m.1010jiajiao.com/timu3_id_74322[举报]

试回答下列问题:
(1)白色沉淀与NaOH溶液反应的离子方程式是
(2)反应F→D的化学方程式是
(3)检验F中金属阳离子的常用方法是
(4)E与石灰乳反应的化学方程式是
| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
(1)按A、B、C顺序,三种元素的金属性逐渐
(2)一定条件下,将4.0mol FE2和3.0mol E2 通入到体积为 2L的密闭容器中.反应达到平衡时,容器中为FE2 0.4mol,则此反应的平衡常数是.改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)E与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X和Y.
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
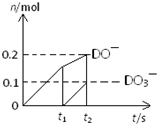
(4)一定量的石灰乳中通入一定量的D单质,两者恰好完全反应,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.则t2时刻消耗氢氧化钙质量为

(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式
| ||
| ||
①酸性高锰酸钾溶液 ②溴水 ③澄清石灰水 ④品红溶液
(2)若A是一种黑色氧化物,B是一种常见的挥发性酸,反应时生成的C是气体,反应的离子方程式是
| ||
| ||
(3)若A是一种双原子分子,B是一种乳状物,得到的C、D混合物化学式分别是
(4)若aA(g)+bB(g)?cC(g)+dD(s)+eE(g)反应中A%随温度和压强的改变如下.

下列判断正确的是
①a+b<c+d+e ②正反应是吸热反应
③加入物质D对平衡没有影响 ④增大加强时平衡左移,平衡常数减小.
⑴(5分)随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成 ,该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是 。
②有些元素是人的生命活动必不可少的,被称为必需元素,目前已经确认的必需元素共27种,其中有16种因为在人体中含量低于0.01%,称为微量元素,另11种元素则占据了人体体重的99.95%,如Na、Mg、K、Ca、P、S、Cl,请写出其余4种常量元素的元素符号________、________、_______、__________。
③构成蛋白质的常见氨基酸大约有20种,部分氨基酸可以在人体内合成,而有8种氨基酸人体自身不能合成,必须通过食物摄入,它们被称为“__________氨基酸”。
⑵(5分)中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 。
②铜锌合金外观和金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法 。铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式 ;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为 。
③下列对金属制品采取的防护方法不正确的是 (填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上锡块
⑶(5分)①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 。
②水中含有重金属离子,可以用_____________去除(填“中和法”、“氧化还原法”、“沉淀法”),如含Cr3+离子的废水中可以加入___________(填化学式)。
③硝酸型酸雨的形成主要是有汽车排放的尾气所致。在汽车发动机中汽缸点火是,空气中的氧气和氮气反应生成NO,NO经过一系列变化形成硝酸,请写出这一过程中发生的反应方程式:___________________________,_____________________________________。
查看习题详情和答案>>已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
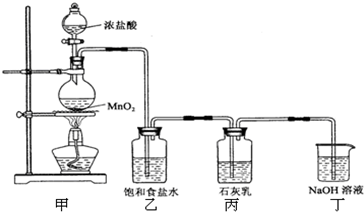
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是
| ||
| ||
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是
| ||
| ||
(3)乙装置的作用是
(4)该兴趣小组用足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2
| ||
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法: