摘要:1475.有水参与的下列反应: ① Na + H2O-, ② Na2O + H2O-, ③ Na2O2 + H2O-, ④ 3Fe+ 4H2O Fe3O4 + 4H2 ,⑤ SO2 + H2O-. 其中水既不是氧化剂.又不是还原剂的反应是( ) A.①③ B.②③⑤ C.③④ D.③④⑤
网址:http://m.1010jiajiao.com/timu3_id_74007[举报]
氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
⑤2H2O 2H2↑+O2↑
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是______(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是______(填编号)
水只作还原剂的反应是______(填编号)水既作氧化剂,又作还原剂是______(填编号)
水既不作氧化剂,又不作还原剂是______(填编号)
(3)根据你的理解,氧化还原反应的实质是______
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是______,还原剂是______.
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:______
②过量二氧化碳通入澄清石灰水:______
③往氯化铝溶液中加入足量的NaOH溶液:______
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:______
②氯气与氢氧化钠溶液反应:______
③铜片与稀硝酸的反应:______.
查看习题详情和答案>>
氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
Fe3O4+4H2
⑤2H2O
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,水只作氧化剂的反应是
水只作还原剂的反应是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入足量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
②氯气与氢氧化钠溶液反应:
③铜片与稀硝酸的反应:
查看习题详情和答案>>
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
③
③
(填编号)(2)在这些氧化还原反应中,水只作氧化剂的反应是
①④
①④
(填编号)水只作还原剂的反应是
⑥
⑥
(填编号)水既作氧化剂,又作还原剂是⑤
⑤
(填编号)水既不作氧化剂,又不作还原剂是
③
③
(填编号)(3)根据你的理解,氧化还原反应的实质是
C
C
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
是
是
(填“是”或“不是”),若是,这个反应的氧化剂是NO2
NO2
,还原剂是NO2
NO2
.(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
②过量二氧化碳通入澄清石灰水:
CO2+OH-=HCO3-
CO2+OH-=HCO3-
③往氯化铝溶液中加入足量的NaOH溶液:
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
2SO2+O2
2SO3
| ||
| 高温高压 |
2SO2+O2
2SO3
| ||
| 高温高压 |
②氯气与氢氧化钠溶液反应:
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
③铜片与稀硝酸的反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
.(2013?闵行区一模)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2.配平下列化学方程式并标明电子转移的方向和数目:
(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
查看习题详情和答案>>
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
c
c
(选填编号).a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
2F2+2H2O=4HF+O2或2Na+2H2O=2NaOH+H2↑或C+H2O
CO+H2
| ||
2F2+2H2O=4HF+O2或2Na+2H2O=2NaOH+H2↑或C+H2O
CO+H2
.
| ||
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2.配平下列化学方程式并标明电子转移的方向和数目:
4
4
NaIO3+10
10
NaHSO3→2
2
I2+7
7
Na2SO4+3
3
H2SO4+2
2
H2O(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
I2
I2
反应,离子方程式为H2O+I2+HSO3-=2I-+SO42-+3H+
H2O+I2+HSO3-=2I-+SO42-+3H+
.下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
Fe3O4+4H2
⑤2H2O
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,
水只作氧化剂的反应是
水只作还原剂的反应是
水既作氧化剂,又作还原剂是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
查看习题详情和答案>>
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
③
③
(填编号).(2)在这些氧化还原反应中,
水只作氧化剂的反应是
①④
①④
(填编号);水只作还原剂的反应是
⑥
⑥
(填编号);水既作氧化剂,又作还原剂是
⑤
⑤
(填编号);水既不作氧化剂,又不作还原剂是
②
②
(填编号).(3)根据你的理解,氧化还原反应的实质是
C
C
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
是
是
(填“是”或“不是”),若是,这个反应的氧化剂是3NO2
3NO2
,还原剂是3NO2
3NO2
.(12分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。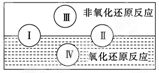
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
其中水为________剂。
(3)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为__________________________。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
________Cu2S+________Fe3++______H2O________Cu2++________Fe2++________( )+________SO42-。
(4)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是 。