网址:http://m.1010jiajiao.com/timu3_id_73226[举报]
(1)写出上述内容涉及的化学方程式。
(2)制取甲硅烷的装置与制取________(填“氧气”“氢气”或“氯气”)的装置相似。
(3)加入稀盐酸之前应向密闭装置中通入一会儿氮气,其目的是______________。
(4)收集甲硅烷气体只能采用________法,这是因为________。收集完甲硅烷气体后不能直接将导气管从水槽中取出,这是为了防止________,正确的操作方法是________________。
(5)为了研究甲硅烷的化学性质,进行如下实验:①将甲硅烷通入少量的高锰酸钾酸性溶液中,发现有二氧化锰生成,同时还生成了所有气体中最轻的气体,然后经测定得知所得溶液为无色的硅酸钾(K2SiO3)溶液,该反应的化学方程式为_______________________。②将甲硅烷通入少量的硝酸银溶液,发现有沉淀生成,然后经测定得知沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀生成;向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。则将甲硅烷通入硝酸银溶液中,发生反应的化学方程式为____________________________________。
(6)制完甲硅烷后,检验装置中是否有残留的甲硅烷的方法是_________________________。
查看习题详情和答案>>(1)制取氧气
①用20%的H2O2溶液,通过反应2H2O2![]() 2H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是_____________;
2H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是_____________;
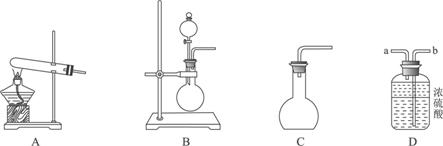
②与气体发生装置相连接的D装置的导管口是_____________;
③为了能使产生的氧气被充分干燥,可采取的操作是______________________________。
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知:铜与氧气的反应有:①2Cu+O2![]() 2CuO,②4CuO
2CuO,②4CuO![]() 2Cu2O+O2↑;在酸性条件下:2Cu+(aq)====Cu(s)+Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
2Cu2O+O2↑;在酸性条件下:2Cu+(aq)====Cu(s)+Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有Cu2O,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有_____________,则说明固体中含有Cu2O。
乙同学的实验方案是:再将粉末X放入氧气中加热,如果其质量增加,则说明其中含有Cu2O。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。
若n的取值范围是__________≤n<__________,则粉末X中含有Cu2O,其物质的量是__________。
请你再设计一个与上述三个实验方案中现象不同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有Cu2O。写出该实验中离子反应的方程式。
查看习题详情和答案>>甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
①用20%的H2O2溶液,通过反应2H2O2MnO22H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是______
 |
②与气体发生装置相连接的D装置的导管口是______
③为了能使产生的氧气被充分干燥,可采取的操作是
_________________________________________________________________________________
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知:铜与氧气的反应有:①2Cu+O2△\s\up2 (——2CuO,②4CuO>1000℃2Cu2O+O2↑;在酸性条件下:2Cu+(aq)——Cu(s)+
Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有Cu2O,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X加入稀硫酸,若有 ,则说明固体中含有Cu2O。
乙同学的实验方案是:再将粉末X放入氧气中加热,如果其质量增加,则说明其中含有Cu2O。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。
若n的取值范围是 ≤n<_____,则粉末X中含有Cu2O,其物质的量是___________。
请你再设计一个与上述三个实验方案中现象不同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有Cu2O。写出该实验中离子反应的方程式。
查看习题详情和答案>>甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
①用20%的![]() 溶液,通过反应
溶液,通过反应![]() 来制取氧气,则在下列A、B、C三装置中最佳装置是_____
来制取氧气,则在下列A、B、C三装置中最佳装置是_____

②与气体发生装置相连接的D装置的导管口是_____
③为了能使产生的氧气被充分干燥,可采取的操作是
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知: 铜与氧气的反应有:①![]() ,②
,②![]() ;在酸性条件下:
;在酸性条件下:![]() 。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(
。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(![]() )。
)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有![]() ,甲、乙、丙三同学分别设计如下实验方案。
,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有___ ,则说明固体中含有![]() 。
。
乙同学的实验方案是:再将粉末X放人氧气中加热,如果其质量增加,则说明其中含有![]() 。
。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。若n的取值范围是![]() ,则粉末X中含有
,则粉末X中含有![]() ,其物质的量是_____。
,其物质的量是_____。
请你再设计一个与上述三个实验方案中现象均不相同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有![]() 。写出该实验中反应的离子方程式。
。写出该实验中反应的离子方程式。
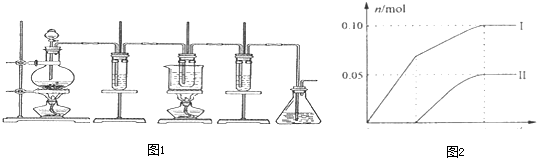
如图所示,是制取氯气并探究氯气的性质的实验装置.图1中:①氯气发生装置;②溴化亚铁溶液;③15mL 30% KOH溶液,并置于水浴中;④石灰乳;⑤尾气吸收装置.已知:氯气和碱的反应为放热反应.温度较高时,氯气和碱还能发生如下反应:
3Cl2+6OH-
| ||
(1)实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)通入足量氯气后,②中反应的化学方程式为
(3)利用③反应后的溶液可制备KClO3晶体,实验过程:溶液→蒸发浓缩→冷却结晶→过滤→洗涤→干燥→氯酸钾晶体.蒸发浓缩时,当
(4)④的产物中Ca(ClO)2的质量明显小于理论值.为探究产物的组成,另取一定量的石灰乳,缓慢、匀速地通入足量氯气,ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线如图2所示(不考虑氯气和水的反应).则图2中曲线I表示