网址:http://m.1010jiajiao.com/timu3_id_73205[举报]
(1)一定条件下硝酸铵受热分解的未配平化学反应方程式为:NH4NO3—HNO3+N2+H2O在反应中被氧化与被还原的氮原子数之比为_________。
(2)某硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体,若产生NO2和O2的物质的量之比为8∶1,则金属元素的价态在反应过程中_________(填“升高”“降低”“不变”)。若该硝酸盐的化学式表示为M(NO3)2,则其受热分解的化学方程式为______________________________。
(3)2 mol Cu(NO3)2和AgNO3混合物,加热使其分解,得到NO2、O2两种气体和CuO、Ag二种固体,将产生的NO2、O2混合气体经水充分吸收后,剩余气体是____________________,其物质的量(mol)范围是_______________________________________。
查看习题详情和答案>>硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关.
(1)一定条件下硝酸铵受热分解的化学反应方程式为:
NH4NO3-HNO3+N2+H2O(未配平)
反应中生成的氧化产物是__________;
在反应中被氧化与被还原的氮原子数之比为__________;
反应中若产生0.2 mol N2气体,则转移电子的物质的量是________mol.
(2)某硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体,若产生NO2和O2的物质的量之比为8∶1,则金属元素的价态在反应过程中________(填“升高”、“降低”、“不变”).
硝酸盐受热分解的产物与其组成及受热温度等有关。
(1)一定条件下硝酸铵受热分解的化学反应方程式为:
NH4NO3―HNO3+N2+H2O(未配平)
由该反应的氧化产物是 ,在反应中被氧化与被还原的氮原子数
之比为 。
(2)某金属元素的硝酸盐受热分解的产物为不含氮元素的固体物质:NO2和O2。若产生的NO2和O2的物质的量之比为8:1,则金属元素的化合价在反应过程中 (填“升高”、“降低”或“不变”)。
查看习题详情和答案>>2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
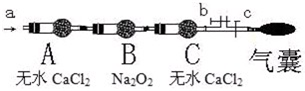
步骤二:操作(如图,b、c为弹簧夹)
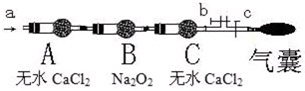
①先打开b关闭c,通入
A.空气 B.O2C.CO2 D.N2
②然后
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:
请写出NO2与 Na2O2反应的化学方程式: