网址:http://m.1010jiajiao.com/timu3_id_72779[举报]
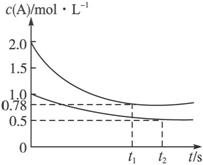
(8分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1

A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78 mol·L-1
D.若向甲容器中再充入2 mol A、4 mol B,平衡时甲容器中c(A)大于1.56 mol·L-1
查看习题详情和答案>>
| |||||||||||||||||||||||||||
向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B.相同条件下(温度T℃),发生下列反应:A(g)+B(g)![]() xC(g) ΔH<0.测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0.测得两容器中c(A)随时间t的变化如图所示:

回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T℃时该反应的平衡常数为________;
(4)下列说法正确的是________.
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
(12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
