摘要:已知某溶液中只存在OH-.Cl-.NH4+.H+四种离子.下列说法不正确的是( ) A.若溶液中c(NH4+)=c(Cl-).则该溶液一定显中性 B.若溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+).则溶液中一定含有NH4Cl和NH3·H2O C.若溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-).则溶液中可能含有NH4Cl或可能含有NH4Cl和HCl D.若溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-).则溶液中含有大量的NH4Cl和少量的HCl [解析]选D.A项.若溶液中c(NH4+)=c(Cl-).由电荷守恒知c(OH-)=c(H+).则该溶液一定显中性.B项.溶液呈碱性.溶质只能是NH4Cl和NH3·H2O,C项.溶液呈酸性.溶质可能含有NH4Cl或可能含有NH4Cl和HCl,但若溶质是大量的NH4Cl和少量的HCl.则c(Cl-)>c(NH4+)>c(H+)>c(OH-).D项错误.
网址:http://m.1010jiajiao.com/timu3_id_71612[举报]
(2010?郑州一模)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是
(2)若四种离子的关系符合③,则溶质为
若四种离子的关系符合④,则溶质为
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图1正确的是(填图象符号)
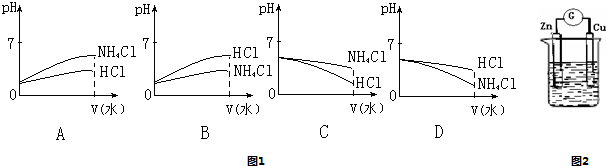
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
(5)如图2所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是
查看习题详情和答案>>
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是
NH4Cl
NH4Cl
,上述四种离子浓度的大小顺序为(填序号)①
①
;(2)若四种离子的关系符合③,则溶质为
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
;若四种离子的关系符合④,则溶质为
NH4Cl和HCl
NH4Cl和HCl
;(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图1正确的是(填图象符号)
B
B
;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
小于
小于
c(NH3?H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)大于
大于
c(OH-).(5)如图2所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是
Zn
Zn
,正极反应式是2H++2e-=H2↑
2H++2e-=H2↑
.已知某溶液中只存在OH-、H+、NH
、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH
)>c(H+)>c(OH-)
②c(NH
)>c(OH-)>c(Cl-)>c(H+)
③c(NH
)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是
(2)若四种离子的关系符合③,则溶质为
若四种离子的关系符合④,则溶质为
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图象正确的是(填图象符号)
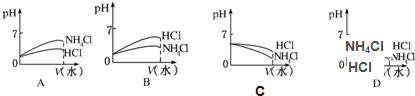
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
查看习题详情和答案>>
+ 4 |
①c(Cl-)>c(NH
+ 4 |
②c(NH
+ 4 |
③c(NH
+ 4 |
④c(Cl-)>c(H+)>c(NH
+ 4 |
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是
NH4Cl
NH4Cl
,上述四种离子浓度的大小顺序为(填序号)①
①
;(2)若四种离子的关系符合③,则溶质为
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
;若四种离子的关系符合④,则溶质为
NH4Cl和HCl
NH4Cl和HCl
;(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图象正确的是(填图象符号)
B
B
;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
小于
小于
c(NH3?H2O)(填“大于”“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)大于
大于
c(OH-).(2011?朝阳区二模)已知某溶液中只存在OH-、H+、Cl-、NH4+四种离子,其离子浓度可能有如下关系:下列说法正确的是( )
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(NH4+)=c(Cl-)>c(OH-)=c(H+)
查看习题详情和答案>>
Ⅰ.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶质是
(2)若溶液中溶解了两种溶质,如果上述关系①是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)
Ⅱ.1919年,Langmuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体.等电子体的结构相似、物理性质相近.
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的微粒,只要其原子数相同,各微粒最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:
(3)CNS-、NO2+具有相同的通式:AX2,它们的价电子总数都是16,因此,它们的结构与由第二周期两元素组成的
查看习题详情和答案>>
①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
②c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶质是
CH3COONa
CH3COONa
,则该溶液中四种离子浓度的大小顺序符合上述4种关系中的③
③
.(填序号)(2)若溶液中溶解了两种溶质,如果上述关系①是正确的,则溶液中的溶质为
CH3COOH和CH3COONa
CH3COOH和CH3COONa
;如果上述关系②是正确的,则溶液中的溶质为CH3COONa和NaOH
CH3COONa和NaOH
.(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)
小于
小于
c(CH3COOH)(填“大于”、“小于”、或“等于”,下同),混合后溶液中c(CH3COO-)等于
等于
c(Na+).Ⅱ.1919年,Langmuir提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体.等电子体的结构相似、物理性质相近.
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
N2
N2
和CO
CO
;CO2
CO2
和N2O
N2O
.(2)此后,等电子原理又有所发展.例如,由短周期元素组成的微粒,只要其原子数相同,各微粒最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:
O3
O3
、SO2
SO2
.(3)CNS-、NO2+具有相同的通式:AX2,它们的价电子总数都是16,因此,它们的结构与由第二周期两元素组成的
CO2
CO2
分子的结构相同(填化学式),微粒构型呈直线
直线
形.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是
(2)若溶液中只有一种溶质,则该溶质为
(3)若关系③正确,则溶液中溶质为
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va
查看习题详情和答案>>
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是
②
②
(填序号)(2)若溶液中只有一种溶质,则该溶质为
NH4Cl
NH4Cl
,该溶液中离子浓度的大小关系为①
①
(填序号)(3)若关系③正确,则溶液中溶质为
NH4Cl和NH3?H2O
NH4Cl和NH3?H2O
.(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显
中性
中性
(填“酸性”、“碱性”、“中性”).(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va
>
>
Vb(填>、<、=、无法确定)