摘要:向饱和Na2CO3溶液中通入足量CO2.结果有晶体析出.对析出晶体的原因分析错误的是 A.相同温度下.Na2CO3的溶解度大于NaHCO3 B.溶液中溶剂减少了 C.溶质质量增加了 D.反应过程放热 [解析]选D.产生沉淀的原因不是产生的碳酸氢钠不溶于水,而是因为碳酸氢钠溶液达到了饱和,不能溶解的碳酸氢钠沉淀了下来.从化学方程式中可以算出,如果有106克碳酸钠参加反应的话,可以生成168克碳酸氢钠.因为原溶液是"饱和"的碳酸钠,反应过程中又消耗了一部分的水.且同温度下,碳酸钠的溶解度要大于碳酸氢钠,所以产生的碳酸氢钠无法全部溶解.就产生了沉淀.D项不正确.
网址:http://m.1010jiajiao.com/timu3_id_71117[举报]
下列实验“操作和现象”与“结论”对应关系正确的是( )
|
查看习题详情和答案>>
(2013?朝阳区二模)某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
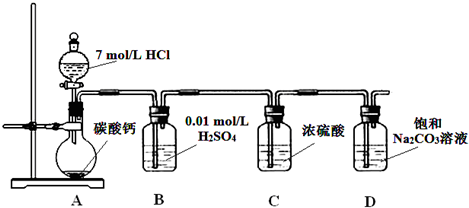
(1)D中产生NaHCO3的化学方程式是
(2)请结合化学平衡移动原理解释B中溶液的作用
(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用.为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀.实验小组对现象产生的原理进行分析,认为该方案不合理,理由是
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生.实验小组认为固体中存在NaHCO3,其离子方程式是
③方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是
乙同学:利用仪器测定了固体残留率(残留率=
×100%)随温度变化的曲线,如图所示.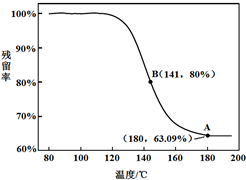
a.根据A点坐标得到的结论是
b.根据B点坐标,计算残留固体中n(NaHCO3):n(Na2CO3)=
通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3.
查看习题详情和答案>>

(1)D中产生NaHCO3的化学方程式是
Na2CO3+CO2+H2O═2NaHCO3
Na2CO3+CO2+H2O═2NaHCO3
.(2)请结合化学平衡移动原理解释B中溶液的作用
CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体
.(3)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用.为确定固体的成分,实验小组设计方案如下(称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀.实验小组对现象产生的原理进行分析,认为该方案不合理,理由是
Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3
Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3
.②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生.实验小组认为固体中存在NaHCO3,其离子方程式是
2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O
2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O
.该小组认为不能确定是否存在Na2CO3,你认为该结论是否合理?合理
合理
.③方案3:实验小组中甲、乙同学利用NaHCO3的不稳定性进行如下实验:
甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是
冷却到室温,加水至溶液体积为400mL,再次测定pH
冷却到室温,加水至溶液体积为400mL,再次测定pH
,结果表明白色固体中存在NaHCO3.为进一步证明白色固体是否为纯净的NaHCO3,结合甲同学实验,还应补充的实验是取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照
取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照
.乙同学:利用仪器测定了固体残留率(残留率=
| 剩余固体的质量 | 原始固体的质量 |

a.根据A点坐标得到的结论是
白色固体为NaHCO3
白色固体为NaHCO3
.b.根据B点坐标,计算残留固体中n(NaHCO3):n(Na2CO3)=
1.7
1.7
.通过上述实验,该小组认为,可以向饱和Na2CO3溶液中通入过量CO2制备NaHCO3.
下列实验操作与预期目的或所得结论一致的是( )
查看习题详情和答案>>
| 选项 | 实验操作与现象 | 实验目的或结论 |
| A | 将盛有20g氯化铵与40g氢氧化钡晶体混合物的塑料袋放置到洒有少量水的小木板上,发现塑料袋和小木板粘在一起 | 说明该反应是吸热反应,且属于非自发反应 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C | 在苯酚钠溶液中通入CO2,可观察到有白色浑浊产生 | 验证碳酸酸性较苯酚强 |
| D | 向含少量苯酚的苯中加入适量溴水,过滤 | 可除去苯酚 |
(2012?长宁区一模)向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
|
查看习题详情和答案>>
下述实验操作与预期实验目的或所得实验结论不一致的是( )
|
| A、A | B、B | C、C | D、D |