网址:http://m.1010jiajiao.com/timu3_id_69558[举报]
 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题:(1)实验室常有下列仪器:A试管、B烧杯、C量筒、D容量瓶、E烧瓶、F酸式滴定管、
G蒸发皿、H坩埚等(用仪器序号填空)
①上述仪器中可以用来加热,但必须垫上石棉网的是
②“磨砂”是给玻璃仪器加强密闭防漏的一种处理工艺.上述仪器中使用了“磨砂”处理工艺的是
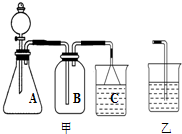
(2)用图甲装置能够完成下列实验中的
A.用锌粒与稀硫酸制取氢气
B.用浓硫酸与浓盐酸制取HCl
C.用浓氨水与生石灰制取NH3
D.用铜与浓硝酸反应制取NO2
(3)如用乙代替甲中的C重新组装成一套 装置,用KMnO4、浓HCl、NaBr溶液、NaOH 溶液来验证KMnO4、Cl2、Br2的氧化性强弱顺序.实验时观察到B中的现象是
(4)某久置的亚硫酸钠样品已部分变成硫酸钠.某同学为测定该样品中亚硫酸钠的质量分数,称取m1g该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全.经过滤、洗涤、干燥、称量得m2g沉淀.
①判断SO42-沉淀完全的实验方法是
②该样品中亚硫酸钠的质量分数是
| 233m1-142m2 |
| 233m1 |
| 233m1-142m2 |
| 233m1 |
 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题:
(1)实验室常有下列仪器:A试管、B烧杯、C量筒、D容量瓶、E烧瓶、F酸式滴定管、
G蒸发皿、H坩埚等(用仪器序号填空)
①上述仪器中可以用来加热,但必须垫上石棉网的是______.
②“磨砂”是给玻璃仪器加强密闭防漏的一种处理工艺.上述仪器中使用了“磨砂”处理工艺的是______.
(2)用图甲装置能够完成下列实验中的______.(填序号)
A.用锌粒与稀硫酸制取氢气
B.用浓硫酸与浓盐酸制取HCl
C.用浓氨水与生石灰制取NH3
D.用铜与浓硝酸反应制取NO2
(3)如用乙代替甲中的C重新组装成一套 装置,用KMnO4、浓HCl、NaBr溶液、NaOH 溶液来验证KMnO4、Cl2、Br2的氧化性强弱顺序.实验时观察到B中的现象是______.
(4)某久置的亚硫酸钠样品已部分变成硫酸钠.某同学为测定该样品中亚硫酸钠的质量分数,称取m1g该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全.经过滤、洗涤、干燥、称量得m2g沉淀.
①判断SO42-沉淀完全的实验方法是______.
②该样品中亚硫酸钠的质量分数是______(用m1、m2的代数式表示).如果过滤后省去沉淀的洗涤操作,则测得的亚硫酸钠的质量分数______(填“偏大”、“偏小”或“无影响”).
查看习题详情和答案>>
波谱分析分析是鉴定有机物分子结构的有效手段。某有机物A经波谱分析有如下信息:质谱显示A的分子离子峰质荷比为94,红外光谱得知A分子中存在C-O键、H-O键、苯环且无其他化学键,A的核磁共振氢谱中有6个吸收峰,峰面积之比为1∶1∶1∶1∶1∶1。回答下列问题:
⑴ A的结构简式为 ;
⑵ 实验室模拟处理含A的工业废水并回收A的流程图如下:

① 步骤Ⅰ中的操作名称是 ,使用的仪器是 ;
② 步骤Ⅱ中NaOH溶液的作用是 ;步骤Ⅲ中的化学反应方程式为 ;
③ 步骤Ⅳ中分离出物质丙的操作名称是 ;
④ 为体现绿色化学思想,上述流程中 是循环使用的。
查看习题详情和答案>>[实验原理]
醇分子间脱水生成醚是制备简单醚的常用方法.用硫酸作为催化剂,在不同温度下正丁醇和硫酸作用生成的产物会有不同,主要是正丁醚或丁烯,因此反应必须严格控制温度.
主反应:2CH3CH2CH2CH2OH
| H2SO4、134~135℃ |
副反应:CH3CH2CH2CH2OH
| H2SO4 |
| 135℃ |
[仪器和药品]
仪器:50mL园底烧瓶、回流冷凝管、油水分离器、分液漏斗.
药品:正丁醇、浓硫酸、50%硫酸、无水氯化钙
[实验步骤]
(1)如右图所示,在干燥的50mL园底烧瓶中,放入20.5mL (15.8g)正丁醇和2.5mL浓硫酸,充分振摇使混和均匀,并加入几粒沸石.装上油水分离器,油水分离器上端接一冷凝管,先在分水器中放置V mL水,然后加热,使瓶内液体微沸,开始反应.

(2)随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇,经冷凝管冷凝后聚集于分水器内,由于比重的不同,水在下层,而上层较水轻的有机相积至分水器支管时即可返回反应瓶中,继续加热,分水器被水充满时,表示反应已基本完成,约需1h.
(3)反应物冷却后,把混合物连同分水器里的水一起倒入盛有25mL水的分液漏斗中,充分振摇,静止后,分出粗产物正丁醚,用16mL 50%硫酸分2次洗涤,再用10mL水洗涤.然后用无水氯化钙干燥.将干燥后的产物倾入蒸馏烧瓶中,加热蒸馏,收集139~143°C馏分.纯正丁醚的沸点为142°C,密度0.7689g/ml.
请回答下列问题:
(1)步骤(1)中加入沸石的目的:
(2)油水分离器的体积为5ml,则预先在分水器加入V mL水,理论上V约为
(3)若实验中分出的水量超过理论数值,试分析其原因
(4)步骤(3)中用16mL 50%硫酸分2次洗涤的目的是:
塑料袋的广泛使用,给我们的日常生活中带来了便利.常用的塑料袋有两种,一种是用聚乙烯
[(C2H4)n]制成的,另一种是用聚氯乙烯[(C2H3Cl)n]制成的.某化学兴趣小组的同学收集了一种日常生活中常用的塑料袋,对其组成进行了如下探究:Ⅰ.鉴别和分析
①取样,用坩埚钳夹持在酒精灯上燃烧,火焰呈黄色,且无刺鼻气味;由此可以初步确定该塑料袋可能是由
________制成的(填“聚乙烯”或“聚氯乙烯”).②由于空气中氧气的体积分数为
21%,因此用燃烧法确定塑料袋组成时,由于可能会生成既会产生污染,又会增加实验难度和实验误差的有毒气体________,故必须使用纯氧.Ⅱ.设计与实验
同学们设计了如下图所示的装置,按下述步骤进行实验:

①连接好装置,检查气密性;
②称取
7.0 g塑料样品,放入装置C中.称量D、E的质量;③通入氧气一段时间后,加热塑料样品,使其燃烧;
④塑料样品燃烧结束后,停止加热;
⑤继续通氧气至玻璃管冷却后,停止通氧气;
⑥再次称量
D、E的质量.(3)思考与结论
①仪器F的作用是________;
②实验前将所用的塑料样品剪成碎屑的目的是________;
③将上述实验操作中的④、⑤颠倒可能导致的不良后果是________;
④若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果________(填“偏小”、“偏大”、“无影响”中之一).
⑤实验后发现D、E装置分别增重9.0 g、22.0 g,则该塑料中碳、氢元素质量比为________.
⑥塑料由于难以降解,造成白色污染.请说出生活中减少白色污染的一点措施:________.装置(填序号).