摘要:12.是人体必需的一种微量元素.其单质可用于制光敏电阻.复 印机的硒鼓等等.工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料.得 到亚硒酸(H2SeO3)和少量硒酸(H2SeO4).富集后再将它们与盐酸共热.将H2SeO4转化为 H2SeO3.主要反应为2HCl+H2SeO4===H2SeO3+H2O+Cl2↑.然后向溶液中通入SO2 将硒元素还原为单质硒沉淀.据此正确的判断为 ( ) A.H2SeO4的氧化性比Cl2弱 B.SeO2的氧化性比SO2弱 C.H2SeO4的氧化性比H2SeO3强 D.浓H2SeO4的氧化性比HNO3强 解析 根据方程式可知氧化性:H2SeO4>H2SeO3.H2SeO4>Cl2.所以A项错误.C项正 确,SO2可以把H2SeO3还原为Se单质.说明+4价Se的氧化性比SO2强.所以B项错 误,由题意知HNO3能将工业废料中的硒氧化为H2SeO3和少量H2SeO4.所以HNO3的 氧化性比H2SeO4强.D项错误. 答案 C
网址:http://m.1010jiajiao.com/timu3_id_69313[举报]
|
硒(Se)是人体必需的一种微量元素,其单质可用于制光敏电阻、复印机的硒鼓等等.工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料,得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),富集后再将它们与盐酸共热,将H2SeO4转化为H2SeO3,主要反应为2HCl+H2SeO4 | |
| [ ] | |
A. |
H2SeO4的氧化性比Cl2弱 |
B. |
SeO2的氧化性比SO2弱 |
C. |
H2SeO4的氧化性比H2SeO3强 |
D. |
浓H2SeO4的氧化性比HNO3强 |
下列说法中,不正确的是( )
| A、根据元素在人体中含量的高低,可分为常量元素和微量元素 | B、为了预防甲状腺疾病,应大量食用加碘盐或含碘食品 | C、铁是人体必需的一种微量元素,主要参与血红蛋白、肌蛋白等的合成 | D、适当使用含氟牙膏能防止龋齿 |
硒是制光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如图1,请回答下列问题:
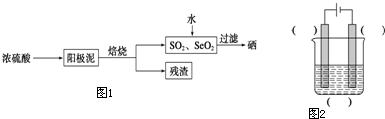
(1)实验室中电解精炼铜的简易装置如图2所示,请在图中标出电极材料和电解液的名称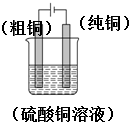
 .
.
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se和浓硫酸反应的化学方程式为
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为
(4)上述硒的提取过程中存在的主要问题是
查看习题详情和答案>>

(1)实验室中电解精炼铜的简易装置如图2所示,请在图中标出电极材料和电解液的名称


(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se和浓硫酸反应的化学方程式为
Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O
| ||
Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O
.
| ||
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为
H2SeO3+2SO2+H2O═Se+2SO42-+4H+
H2SeO3+2SO2+H2O═Se+2SO42-+4H+
.电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为H2SeO3-2e-+H2O═SeO42-+4H+
H2SeO3-2e-+H2O═SeO42-+4H+
.(4)上述硒的提取过程中存在的主要问题是
浓硫酸的腐蚀性强
浓硫酸的腐蚀性强
、焙烧过程中产生大量有毒气体SO2,污染环境
焙烧过程中产生大量有毒气体SO2,污染环境
.