网址:http://m.1010jiajiao.com/timu3_id_68278[举报]
已知苯酚能跟碳酸钠溶液反应而溶解于碳酸钠溶液中。在下图所示的转化关系中,括号内编号①—④表示转化所需化学试剂: ![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m

(1)用化学式填空:
①是 、②是 、
③是 、④是 、
(2)写出A直接生成C的化学反应方程式:
查看习题详情和答案>>已知![]()
![]() :
:
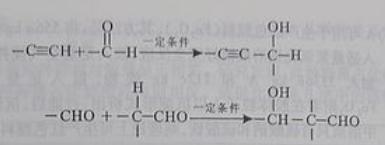
以乙炔为原料,通过下图所示步骤能合成有机中间体E(转化过程中的反应条件及部分产物已略去)。![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
![]()
其中,A,B,C,D分别代表一种有机物,B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1) A生成B的化学反应类型是____________________________。
(2) 写出生成A的化学反应方程式_________________________________________。
(3) B在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比A小的有机产物的结构简式:_________________、__________________。
(4) 写出C生成D的化学反应方程式:
__________________________________________________________________。
(5)含有苯环,且与E互为同分异构体的酯有______种,写出其中一种同分异构体的结构简式:____________________________________________________________________。
查看习题详情和答案>>为除去下表所列物质含有的少量杂质(括号内为杂质),在A项中选择试剂,在B项中选择操作的方法,将其代号填入表中:

 w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
A:(1)NaCl细颗粒; (2)NaOH溶液; (3)水; (4)CaO;
(5)饱和Na2CO3; (6)溴水; (7)KMnO4溶液。
B:(1)过滤; (2)盐析; (3)蒸馏; (4)分液; (5)结晶;
(6)洗气; (7)渗析
| 物质 | 蛋白质溶液 (氯化钠溶液) | 乙 烷 (乙烯) | 肥 皂 (甘油) | 乙醇(水) | 乙酸乙酯(乙酸) | 溴苯(溴) |
| 加入试剂 | | | | | | |
| 操作方法 | | | | | | |
玻璃棒是化学实验中常用的仪器,下列有关实验过程需要使用玻璃棒进行操作的是
① 用pH试纸测定溶液的pH
② 将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
③ 从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
④ 用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
⑤ 用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
⑥ 实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
A.①②⑥ B.③④⑥ w.k_s5% C.②④⑤ D.①③⑤
查看习题详情和答案>>
四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m

请回答下列问题:![]()
![]()
![]() w_w w. k#s5_u.c o*m
w_w w. k#s5_u.c o*m
(1) 硫酸与二氧化钛反应的化学方程式是____________________________________。
(2) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
查看习题详情和答案>>