摘要:容易题 约80% 中等难题 约10% 稍难题 约10% 全卷难度值约为0.80-0.85
网址:http://m.1010jiajiao.com/timu3_id_66944[举报]
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
【小题1】属于离子结构示意图的是 、 (填写微粒符号)。
【小题2】五种粒子中,性质最稳定的原子是 (用微粒符号填写,在本小题中下同),最容易失去电子的原子是 ,最容易得到电子的原子是 。
【小题3】A、E两种元素形成的化合物在水溶液中的电离方程式是 。
【小题4】在核电荷数为1-18的元素中,写出两种与B核外电子层排布相同的离子,其离子的符号为 、 (A-E中已出现的元素除外)。
【小题5】在一定条件下,D可以和氮气(N2)化合成一种白色物质,该物质的化学式是 。
(2008?天津)Ⅰ.化学实验室制取气体的方法之一是将浓硫酸滴入浓盐酸中.请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂.(仪器可重复使用,固定装置不必画出)
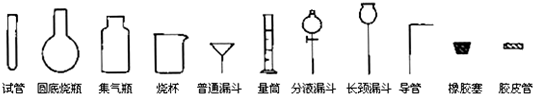
Ⅱ.实验室制备少量硫酸亚铁品体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式:
(2)硫酸溶液过稀会导致
(3)采用水浴加热的原因是
(4)反应时铁屑过量的目的是(用离子方程式表示)
(5)溶液趁热过滤的原因是
(6)静置冷却一段时间后,在试管中观察到的现象是
查看习题详情和答案>>

Ⅱ.实验室制备少量硫酸亚铁品体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式:
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(2)硫酸溶液过稀会导致
反应速率慢 不利于晶体析出
反应速率慢 不利于晶体析出
.(3)采用水浴加热的原因是
容易控制温度
容易控制温度
.(4)反应时铁屑过量的目的是(用离子方程式表示)
Fe+2Fe3+═3Fe2+
Fe+2Fe3+═3Fe2+
.(5)溶液趁热过滤的原因是
减小FeSO4的损失
减小FeSO4的损失
.塞紧试管口的目的是防止空气进入试管将Fe2+氧化为Fe3+
防止空气进入试管将Fe2+氧化为Fe3+
.(6)静置冷却一段时间后,在试管中观察到的现象是
有浅绿色晶体析出
有浅绿色晶体析出
.(1)金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳与钢铁表面吸附的一层水膜构成许多微小的
(2)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
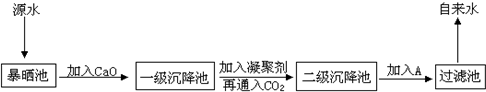
①源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO,再通入CO2可以降低水中Ca2+、Mg2+等离子的浓度,从而将硬水转化为
②该水厂加入的A物质常为氯气,其作用是
③加入凝聚剂可以除去其中的悬浮固体颗粒,以下物质中不能作为凝聚剂的是(填写编号)
A.KAl(SO4)2?12H2O B.Fe2(SO4)3 C.CuSO4 D.FeSO4?7H2O.
查看习题详情和答案>>
原电池
原电池
发生电化学腐蚀,该腐蚀中负极发生的电极反应式为Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(2)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:

①源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO,再通入CO2可以降低水中Ca2+、Mg2+等离子的浓度,从而将硬水转化为
软
软
水.②该水厂加入的A物质常为氯气,其作用是
杀菌、消毒
杀菌、消毒
.③加入凝聚剂可以除去其中的悬浮固体颗粒,以下物质中不能作为凝聚剂的是(填写编号)
C
C
.A.KAl(SO4)2?12H2O B.Fe2(SO4)3 C.CuSO4 D.FeSO4?7H2O.