网址:http://m.1010jiajiao.com/timu3_id_66017[举报]
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04.5H20).经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH 如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验小组设计如下实验方案:
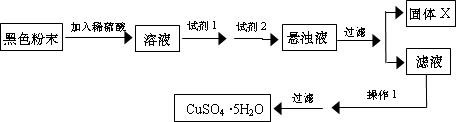
试回答:
①试剂I为
②固体X的化学式为
③操作I为
(2)正常人体内铁元素以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.则,在人体中进行①Fe2+→Fe3+的转化时,Fe2+作
②Fe3+→Fe2+的转化时,Fe3+作
研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5mol K2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42−+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42−
电解池中阴极反应式____________。
查看习题详情和答案>>
研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42?+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42?
电解池中阴极反应式____________。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42?+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42?
电解池中阴极反应式____________。