摘要:使用催化剂不一定就能加快反应速率.
网址:http://m.1010jiajiao.com/timu3_id_65651[举报]
下列说法中正确的是( )
A. 在其他条件不变时,使用催化剂可以改变化学反应速率,提高产率。
B. 增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C. 一定条件下增大反应物的量,一定会加快化学反应速率
D. 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
查看习题详情和答案>>下列有关活化分子的说法中不正确的是
A.具有一定能量、能发生有效碰撞的分子叫做活化分子
B.当活化分子沿着一定的空间取向相互碰撞时才能发生有效碰撞
C.只要外界条件的改变引起活化分子数的增多就能加快反应速率
D.升高温度和使用适当的催化剂都能提高活化分子的百分数
查看习题详情和答案>>下列说法不正确的是
- A.参加反应的物质的性质是决定化学反应速率的主要因素
- B.光是影响某些化学反应速率的外界条件之一
- C.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度
- D.不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率
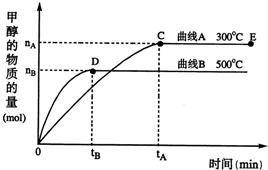 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
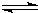 CH3OH(g)
CH3OH(g)根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
减小
减小
(填“增大”、“减小”或“不变”).(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
bc
bc
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时
| n(H2) |
| n(CH3OH) |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
Cu2O+CO 2Cu+CO2
2Cu+CO2
 2Cu+CO2
2Cu+CO2Cu2O+CO 2Cu+CO2
2Cu+CO2
(用化学方程式表示). 2Cu+CO2
2Cu+CO2(5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2 或 2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)
CO+O2--2e-=CO2 H2+O2--2e-=2H2O
CO+O2--2e-=CO2 H2+O2--2e-=2H2O
.(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:
CH3OCH3(g)+3O2(g)
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1
| 点燃 |
CH3OCH3(g)+3O2(g)
2CO2(g)+3H2O(l)△H=-1455kJ?mol-1
| 点燃 |

随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)
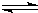
CH3OH(g)
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______(用 nB tB 表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
,下列有关该体系的说法正确的是______
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时
增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______(用化学方程式表示).
(5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2 或 2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)______.
(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:______


查看习题详情和答案>>
CO(g)+2H2(g)
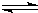
CH3OH(g)
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______(用 nB tB 表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时
| n(H2) |
| n(CH3OH) |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______(用化学方程式表示).
(5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2 或 2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)______.
(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:______

