网址:http://m.1010jiajiao.com/timu3_id_64752[举报]
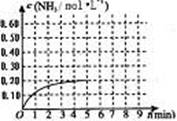
![]() 某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)= 。
(2)该反应的化学平衡常数表达式为 。
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号)
a.0.82mol•L-1 b.0.25mol•L-1 c.0.20mol•L-1 d.0.08mol•L)
|
(5) 其它条件不变,在第5min末将容器的体积缩小
一半,若第8min达到新的平衡(此时NH3的物
质的量约为0.25mol),请在上图中画出第5min
末到此平衡时NH3物质的量浓度的变化曲线。
查看习题详情和答案>>
(2)该反应的化学平衡常数表达式为______.
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______(填序号)
a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡______移动(填“向右”、“向左”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
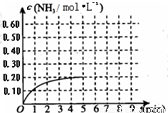
 某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
某温度时,在一容积为1L的密闭容器中,加入 0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如右图所示:
请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)= 。
(2)该反应的化学平衡常数表达式为 。
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号)
a.0.82mol•L-1 b.0.25mol•L-1 c.0.20mol•L-1 d.0.08mol•L)
|
(5) 其它条件不变,在第5min末将容器的体积缩小
一半,若第8min达到新的平衡(此时NH3的物
质的量约为0.25mol),请在上图中画出第5min
末到此平衡时NH3物质的量浓度的变化曲线。
查看习题详情和答案>>
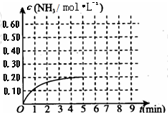 (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=(2)该反应的化学平衡常数表达式为
| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
(3)反应达到平衡后,第5min末保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.82mol?L-1 b.0.25mol?L-1 c.0.20mol?L-1 d.0.08mol?L-1
(4)反应达到平衡后,第5min末保持其他条件不变,若只把容器的体积缩小一半,平衡
(5)其它条件不变,在第5min末将容器的体积缩小一半,若第8min达到新的平衡(此时NH3的物质的量约为0.25mol),请在上图中画出第5min末到此平衡时NH3物质的量浓度的变化曲线.
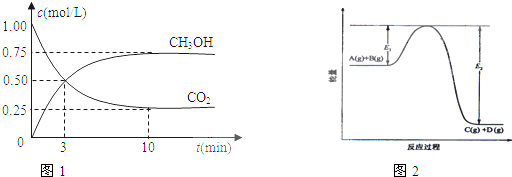
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)该反应的平衡常数表达式为
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1