摘要:30.[物质结构与性质] 钛呈银白色.因它坚硬.强度大.耐热.密度小.被称为高技术金属.目前生产钛采用氯化法.即将金红石或钛铁矿与焦炭混合.通入氯气并加热制得TiCl4: 2FeTiO3+7Cl2+6C2TiCl4+2FeCl3+6CO, TiO2+2Cl2+2CTiCl4+2CO 将TiCl4蒸馏并提纯.在氩气保护下与镁共热得到钛:TiCl4+2MgTi+2MgCl2 MgCl2和过量Mg用稀盐酸溶解后得海绵状钛.再在真空熔化铸成钛锭.请回答下列问题: (1)基态钛原子的价电子排布式为 . (2)与CO互为等电子体的离子为 . (3)在CH2Cl2.C6H6.CO2.C2H4中.碳原子采取sp1杂化的分子有 . (4)TiCl4在常温下是无色液体.在水或潮湿空气中易水解而冒白烟.则TiCl4属于 (填“原子 .“分子 或“离子 )晶体. (5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物.其中一种化学式为[Co(NH3)5Br]SO4.往其溶液中加BaCl2溶液时.现象是 ,往另一种配合物的溶液中加入BaCl2溶液时.无明显现象.若加入AgNO3溶液时.产生淡黄色沉淀.则第二种配合物的化学式为 . (6)在自然界中TiO2有金红石.板钛矿.锐钛矿三种晶型.其 中金红石的晶胞如右图所示.则其中Ti4+的配位数为 .
网址:http://m.1010jiajiao.com/timu3_id_64126[举报]
(三选一)[选修3:物质结构与性质]
氢能被视作连接化石能源和可再生能源的重要桥梁。
(1)水是制取H2的常见原料,下列有关水的说法正确的是________________ 。
a.水分子是一种极性分子
b.H2O分子中有2个由s轨道与sp3杂化轨道形成的 键
键
c.水分子空间结构呈V型
d.CuSO4·5H2O晶体中所有水分子都是配体
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可分解水制取H2同时获得O2。已知钛酸锶晶胞结构如图所示,则钛酸锶的化学式为_______________。
氢能被视作连接化石能源和可再生能源的重要桥梁。
(1)水是制取H2的常见原料,下列有关水的说法正确的是________________ 。
a.水分子是一种极性分子
b.H2O分子中有2个由s轨道与sp3杂化轨道形成的
 键
键 c.水分子空间结构呈V型
d.CuSO4·5H2O晶体中所有水分子都是配体
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可分解水制取H2同时获得O2。已知钛酸锶晶胞结构如图所示,则钛酸锶的化学式为_______________。

(3)氢的规模化储运是氢能应用的关键。
①准晶体Ti38Zr45Ni17的储氢量较高,是一种非常有前途的储氢材料。该材料中,镍原子在基态时核外电子排布式为_________________。
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料。请画出含有配位键(用“→”表示)的氨硼烷的结构式_____________;与氨硼烷互为等电子体的有机小分子是_________________;(写结构简式)。
③甲酸盐/碳酸盐可用于常温储氢,其原理是:甲酸盐在钌催化下会释放出氢气,产生的CO2被碳酸盐捕捉转变碳酸氢盐,碳酸盐又能催化转化为甲酸盐。已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出双聚体结构____________ 。
查看习题详情和答案>>
①准晶体Ti38Zr45Ni17的储氢量较高,是一种非常有前途的储氢材料。该材料中,镍原子在基态时核外电子排布式为_________________。
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料。请画出含有配位键(用“→”表示)的氨硼烷的结构式_____________;与氨硼烷互为等电子体的有机小分子是_________________;(写结构简式)。
③甲酸盐/碳酸盐可用于常温储氢,其原理是:甲酸盐在钌催化下会释放出氢气,产生的CO2被碳酸盐捕捉转变碳酸氢盐,碳酸盐又能催化转化为甲酸盐。已知HCO3-在水溶液中可通过氢键成为二聚体(八元环结构),试画出双聚体结构____________ 。
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
查看习题详情和答案>>
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
(2013?滨州一模)[化学-物质结构与性质]
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn.回答下列问题:

(1)X原子的电子排布式为
(2)电负性:X
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的
化工原料.有关Z2H4分子的说法正确的是
A、分子中含有氢键
B、和O2 分子具有相同的电子数
C、含有4个σ键和1个π键
D.Z的原子与氢原子形成的化学键可以旋转
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图2所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心).

该晶体中,钛离子和周围
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是
A.离子键 B.非极性键 C.配位键 D.金属键.
查看习题详情和答案>>
X、Y、Z三种元素,原子序数依次减小.X是第四周期主族元素,其部分电离能如图1所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn.回答下列问题:

(1)X原子的电子排布式为
1s22s22p63s23p64s2
1s22s22p63s23p64s2
.(2)电负性:X
<
<
Y(填“>”、“=”或“<”).(3)元素Z的一种氢化物(化学式为Z2H4)是重要的
化工原料.有关Z2H4分子的说法正确的是
BD
BD
(填字母).A、分子中含有氢键
B、和O2 分子具有相同的电子数
C、含有4个σ键和1个π键
D.Z的原子与氢原子形成的化学键可以旋转
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构示意图如图2所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心).

该晶体中,钛离子和周围
12
12
(填数字)个氧离子相紧邻.(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是
BD
BD
(填字母).A.离子键 B.非极性键 C.配位键 D.金属键.
(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:
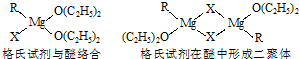
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出 .
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为 ;Mg原子的核外电子排布式可表示为 .
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
Ti+2MgCl2
①Ti元素在元素周期表中的位置是 ,钛原子的外围电子排布式为 .
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于 (填“原子”、“分子”或“离子”)晶体.
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是 .
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键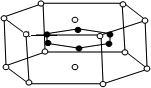
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2.
查看习题详情和答案>>
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:

①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
| ||
①Ti元素在元素周期表中的位置是
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键

(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2.
【化学一物质结构与性质】元素周期表中第四周期元素由于受3d电子的影 响,性质的递变规律与短周期元素略有不同,因此第四周期过渡元素具有和短周期元素不同的明显特征.
请回答下列问题:
(1)CO可以和很多过渡金属形成配合物,CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子里的共价键的类型按原子轨道的重叠方向分有
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但
Ga 的第一电离能却明显低于
Zn,其原因是 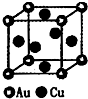
(3)如图是金与铜形成的金属互化物合金,它的化学式可表示为
(4)已知Ti3+可形成配位数为6的配合物;现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体 的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体样品配成待测溶液;
b.分别向待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水 溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
.
则绿色晶体配合物的化学式为
(5)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯和二氧化碳中碳原子均采用Sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲酸高得多,是因为水分子间形成了氢键.
查看习题详情和答案>>
请回答下列问题:
(1)CO可以和很多过渡金属形成配合物,CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子里的共价键的类型按原子轨道的重叠方向分有
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.但
31 |
30 |

(3)如图是金与铜形成的金属互化物合金,它的化学式可表示为
(4)已知Ti3+可形成配位数为6的配合物;现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,但相关实验证明,两种晶体 的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体样品配成待测溶液;
b.分别向待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水 溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
则绿色晶体配合物的化学式为
(5)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯和二氧化碳中碳原子均采用Sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲酸高得多,是因为水分子间形成了氢键.