摘要:用0.1mol/L的Na2SO3溶液30mL.恰如将2×10-3mol的XO4-还原,则元素X在还原产物中的化合价是 +3 (D)+4
网址:http://m.1010jiajiao.com/timu3_id_60640[举报]
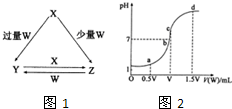 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). (1)若X为金属单质,W是某强酸的稀溶液.X与少量W反应生成Z的离子方程式为
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
,向Y溶液中加入某种试剂硫氰化钾
硫氰化钾
(填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在.(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)若X为强碱,常温下W为有刺激性气味的气态氧化物.常温时,将Z的水溶液露置于空气中,溶液的PH变化是
变小
变小
(填“变大”、“变小”、“不变”.不考虑水的挥发),其原因是亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小
亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小
(用简要的文字说明,并写出离子方程式)(4)室温下,若用0.1mol/L的NaOH溶液滴定VmL0.1mol/L HA溶液,滴定曲线如2图所示,则a、b、c、d四点溶液中水的电离程度最大的是
c
c
点;a点溶液中离子浓度的大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(Na+)>c(H+)>c(OH-)
;取少量c点溶液于试管中,再滴加0.1mol/L盐酸至中性,此时溶液中除H+、OH-外,离子浓度的大小顺序为c(Na+)>c(A-)>c(Cl-)
c(Na+)>c(A-)>c(Cl-)
.某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)
(2)上述B步骤操作的目的是
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是
(4)判断到达滴定终点的实验现象是
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是
查看习题详情和答案>>
A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)
B、D、C、E、A、F
B、D、C、E、A、F
;(2)上述B步骤操作的目的是
滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低
滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低
;(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是
偏高
偏高
;(4)判断到达滴定终点的实验现象是
当溶液由无色变为浅红色,且在半分钟内不褪色
当溶液由无色变为浅红色,且在半分钟内不褪色
;(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是
偏小
偏小
.