摘要:33.答案: 1.88×10-4 mol/C.D. (5)①II:280.1.20×10-3.5.80×10-3 III:1.2×10-3 .5.80×10-3. ②. [解析](1)自发反应.通常为放热反应.即DH小于0. (2)v(N2) == = 1.88×10-4 mol/. (3)从中数据知.在第4s.5s时为平衡状态: 2NO+2CO = 2CO2+N2 c(始)/(×10-4 mol·L-1) 10 36 0 0 c(转)/(×10-4 mol·L-1) 9 9 9 4.5 c(平)/(×10-4 mol·L-1) 1 27 9 4.5 K === 5000. (4)催化剂不影响平衡的移动.A项错.该反应放热.故降温平衡正向移动.NO转化率增大.B项错.C项正确.缩小体积.即增大压强.平衡向体积减小的方向运动.即正向移动.D项正确. (5)本题为实验探究题.目的是研究温度和催化剂的比表面积对反应速率的影响.所以在实验时应保持NO.CO的初始浓度不变.让温度.比表面积其中一个量变化.因此可确定II中温度为280 ℃. 绘图时.要注意达平衡的时间.平衡浓度的相对大小:II与I温度相同.平衡不移动.平衡浓度相同.但催化剂比表面积增大.达平衡时间短,III与II的催化剂比表面积相同.温度升高.不仅达平衡时间缩短.也也平衡向左移动.使NO的平衡浓度也增大.实质I.II研究是催化剂的比表面积对速率的影响.II.III研究是温度对速率的影响.
网址:http://m.1010jiajiao.com/timu3_id_59469[举报]
常温常压下,A、B、C、D均为气态。A与B可发生可逆反应:A+BƒC+nD。若将2mol A和2mol B混合充入体积可变的密闭容器中,在不同条件下达平衡时C的浓度如下:
温度 压强/Pa 平衡浓度/mol×L-1
25℃ 1´105 1.0
25℃ 2´105 1.8
25℃ 4´105 3.2
25℃ 5´105 6.0
(1)可逆反应中系数n的取值范围为_______,理由_______。
(2)在5´105Pa时,D的状态为_______。
查看习题详情和答案>>
已知某条件下,合成氨反应的数据如下:
N2 (g) + 3H2 (g)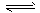 2NH3 (g)
2NH3 (g)
起始浓度/( mol/L) 1.0 3.0 0.2
2s末浓度/(mol/L) 0.6 1.8 1.0
4s末浓度/(mol/L) 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是
N2 (g) + 3H2 (g)
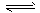 2NH3 (g)
2NH3 (g) 起始浓度/( mol/L) 1.0 3.0 0.2
2s末浓度/(mol/L) 0.6 1.8 1.0
4s末浓度/(mol/L) 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是
[ ]
A.2s末氨气的反应速率为0.4mol·L-1·s-1
B.前2s时间内氨气的平均反应速率为0.4mol·L-1·s-1
C.前4s时间内氨气的平均反应速率为0.3mol·L-1·s-1
D.前2~4s时间内氨气的平均反应速率为0.2mol·L-1·s-1
查看习题详情和答案>>
B.前2s时间内氨气的平均反应速率为0.4mol·L-1·s-1
C.前4s时间内氨气的平均反应速率为0.3mol·L-1·s-1
D.前2~4s时间内氨气的平均反应速率为0.2mol·L-1·s-1
已知合成氨反应的浓度数据如下:
3H2 + N2![]() 2NH3
2NH3
起始(mol·L-1): 3.0 1.0 0
2s末(mol·L-1): 1.8 0.6 0.8
当用氨气浓度的增加来表示该反应的速率时,该反应的速率是
[ ]
|
A.0.2mol·L-1·s-1 |
B.0.4mol·L-1·s-1 |
|
C.0.6 mol·L-1·s-1 |
D.0.8mol·L-1·s-1 |