摘要: (1)Zn2++4OH-=[Zn(OH)4]2- (2分 (2)10-17 (2分 (2分 (4) 1.8 (2分 (5)a b c d (2分漏1个扣一分扣完为止)
网址:http://m.1010jiajiao.com/timu3_id_59379[举报]
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子.以下是化学研究性学习小组的同学对该厂污水处理的设想.
[资料获悉]部分阳离子以氢氧化物或硫化物形式完全沉淀时溶液的pH及硫化物的KSP如下表所示.
| 沉淀物 | Fe(OH)2 | Zn(OH)2 | Hg(OH)2 |
| 沉淀完全的pH | 9.7 | 8.0 | 5.3 |
| 沉淀物 | FeS | ZnS | HgS |
| 沉淀完全的pH | ≥4.92 | ≥2.72 | ≥2.5 |
| KSP | 3.7×10-19 | 1.2×10-23 | 4×10-53 |
设想(二):除去污水中金属离子,回收绿矾、皓矾(ZnSO4?7H2O)和汞.
[药 品]NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉.
[实验探究](1)为了实现设想(一),甲、乙、丙三位同学分别对废水采取以下措施:
甲:加入NaOH溶液,调节溶液pH至10;
乙:加入硫化钠溶液,调节溶液pH至5;
丙:加入硫化亚铁粉末,搅拌.
你认为合理的是______(填“甲”、“乙”或“丙”),理由是______.
(2)研究性学习小组根据设想(二)设计了如图所示的实验方案.

请回答:
①步骤Ⅲ中抽滤的目的是______,抽滤的主要仪器是______.
该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和______.
②欲实现步骤Ⅴ,所需加入的试剂有______、______,所涉及的主要操作依次为______、过滤、______. 查看习题详情和答案>>
下面能够构成原电池及电极反应式正确的是
A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e- ![]() Fe2+
Fe2+
B.Al、Cu、稀硫酸,负极反应式为:Cu-2e- ![]() Cu2+
Cu2+
C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e- ![]() AlO2-+2H2O
AlO2-+2H2O
D.Zn、Cu、乙醇,负极反应式为:Zn-2e- ![]() Zn2+
Zn2+
(2011?临川区模拟)现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来.主要反应为:
2ZnS+3O2
2ZnO+2SO2; 鼓风炉中:2C+O2
2CO ZnO+CO
Zn+CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如图1;硫酸溶液的体积与固体的体积比如图2
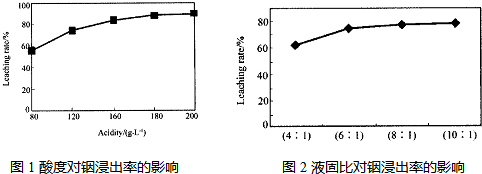
①当酸度为196时,其物质的量浓度为
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式
查看习题详情和答案>>
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来.主要反应为:
2ZnS+3O2
| ||
| ||
| ||
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如图1;硫酸溶液的体积与固体的体积比如图2

①当酸度为196时,其物质的量浓度为
2mol?L-1
2mol?L-1
.②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:
180
180
,6:1
6:1
.(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气
将烟道气净化,用于生产硫酸等
将烟道气净化,用于生产硫酸等
.②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式
Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]
Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-]
.
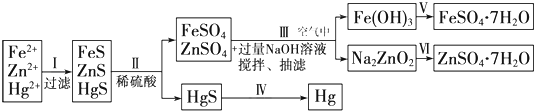
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+离子.以下是某学习小组的同学设计的除去上述金属离子,回收绿矾、皓矾(ZnSO4?7H2O)和汞的探究方案.
已知:KSP(FeS)=6.3×10-18mol2?L-2,KSP(HgS)=6.4×10-53mol2?L-2KSP(ZnS)=1.6×10-24mol2?L-2
药品:NaOH溶液、Na2S溶液、稀硫酸、铁粉 稀硝酸、稀盐酸
[实验方案]
[问题探究]
(1)步骤Ⅰ中加入Na2S溶液时,三种金属离子形成沉淀的先后顺序为 .
(2)步骤Ⅱ中FeS溶解的离子方程式: .
(3)步骤Ⅲ中涉及反应的离子方程式 Zn2++4OH-═ZnO
+2H2O和 .
(4)步骤Ⅲ和步骤Ⅵ发生的相关反应,说明Zn(OH)2属于 _.
(5)欲实现步骤Ⅴ,需加入的试剂为 、 .步骤Ⅴ中从FeSO4溶液浓缩结晶得到FeSO4?7H2O时,需加稀硫酸的原因是 .
(6)步骤Ⅳ常用的方法是加热法,但在空气中加热HgS 会污染环境,其原因可能 .
查看习题详情和答案>>
已知:KSP(FeS)=6.3×10-18mol2?L-2,KSP(HgS)=6.4×10-53mol2?L-2KSP(ZnS)=1.6×10-24mol2?L-2
药品:NaOH溶液、Na2S溶液、稀硫酸、铁粉 稀硝酸、稀盐酸
[实验方案]

[问题探究]
(1)步骤Ⅰ中加入Na2S溶液时,三种金属离子形成沉淀的先后顺序为
(2)步骤Ⅱ中FeS溶解的离子方程式:
(3)步骤Ⅲ中涉及反应的离子方程式 Zn2++4OH-═ZnO
2- 2 |
(4)步骤Ⅲ和步骤Ⅵ发生的相关反应,说明Zn(OH)2属于
(5)欲实现步骤Ⅴ,需加入的试剂为
(6)步骤Ⅳ常用的方法是加热法,但在空气中加热HgS 会污染环境,其原因可能
(2009?宿迁模拟)某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子.以下是化学研究性学习小组的同学对该厂污水处理的设想.
[资料获悉]部分阳离子以氢氧化物或硫化物形式完全沉淀时溶液的pH及硫化物的KSP如下表所示.
[探究思路]设想(一):重点是治理污染,低成本除去重金属离子Zn2+、Hg2+.
设想(二):除去污水中金属离子,回收绿矾、皓矾(ZnSO4?7H2O)和汞.
[药 品]NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉.
[实验探究](1)为了实现设想(一),甲、乙、丙三位同学分别对废水采取以下措施:
甲:加入NaOH溶液,调节溶液pH至10;
乙:加入硫化钠溶液,调节溶液pH至5;
丙:加入硫化亚铁粉末,搅拌.
你认为合理的是
(2)研究性学习小组根据设想(二)设计了如图所示的实验方案.
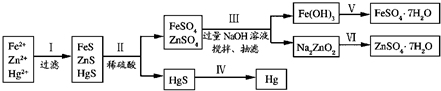
请回答:
①步骤Ⅲ中抽滤的目的是
该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和
②欲实现步骤Ⅴ,所需加入的试剂有
查看习题详情和答案>>
[资料获悉]部分阳离子以氢氧化物或硫化物形式完全沉淀时溶液的pH及硫化物的KSP如下表所示.
| 沉淀物 | Fe(OH)2 | Zn(OH)2 | Hg(OH)2 |
| 沉淀完全的pH | 9.7 | 8.0 | 5.3 |
| 沉淀物 | FeS | ZnS | HgS |
| 沉淀完全的pH | ≥4.92 | ≥2.72 | ≥2.5 |
| KSP | 3.7×10-19 | 1.2×10-23 | 4×10-53 |
设想(二):除去污水中金属离子,回收绿矾、皓矾(ZnSO4?7H2O)和汞.
[药 品]NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉.
[实验探究](1)为了实现设想(一),甲、乙、丙三位同学分别对废水采取以下措施:
甲:加入NaOH溶液,调节溶液pH至10;
乙:加入硫化钠溶液,调节溶液pH至5;
丙:加入硫化亚铁粉末,搅拌.
你认为合理的是
丙
丙
(填“甲”、“乙”或“丙”),理由是硫化亚铁成本低,使沉淀转化成HgS、ZnS沉淀而除去
硫化亚铁成本低,使沉淀转化成HgS、ZnS沉淀而除去
.(2)研究性学习小组根据设想(二)设计了如图所示的实验方案.

请回答:
①步骤Ⅲ中抽滤的目的是
加快过滤速度
加快过滤速度
,抽滤的主要仪器是布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和
4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
.②欲实现步骤Ⅴ,所需加入的试剂有
稀硫酸
稀硫酸
、铁粉(过量)
铁粉(过量)
,所涉及的主要操作依次为溶解
溶解
、过滤、重结晶
重结晶
.