摘要: 解:(1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 3Cu2O + 14HNO3 = 6Cu(NO3)2 + 2NO↑+ 7H2O CuO + 2HNO3 = Cu(NO3)2 + H2O 又据题意:HNO3刚好完全反应.所以据原子守恒知 n[Cu(NO3)2]=[n(HNO3)-n×=0.25 (2)据电子守恒和电子守恒可得: n(Cu) + 2n(Cu2O) < n[Cu(NO3)2] 2n(Cu) + 2n(Cu2O) = n n(Cu) + 2n(Cu2O) < 0.25mol 得: 2n(Cu) + 2n(Cu2O) = 0.3mol 解得:0.005mol<x<0.015mol 2010年高考化学第二轮复习20分钟专题突破(13) 专题 烷烃
网址:http://m.1010jiajiao.com/timu3_id_57652[举报]
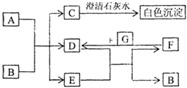 图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:
图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:(1)A元素在元素周期表中位于
第二
第二
周期ⅣA
ⅣA
族,C的化学式是CO2
CO2
.(2)写出D与E反应转化为F和B的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.(3)在常温下,B的稀溶液也可与Cu反应生成F.此反应的离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,虚线框中需连入图乙(仪器的上下端位置固定)的某装置进行实验.图乙中的细铜丝一端被弯成螺旋状,先将铜丝在空气中加热变黑后再迅速伸入制得的氢气中.
(1)在图中,试管M中的液体应选用
(2)在图中的虚线框中应连入的最合适的装置是图乙所示仪器中的
(3)上述制氢气的方法与将锌直接加入试管中相比,其优点有
(4)实验过程中,在试管M中可观察到的现象是
(5)用上面的装置也可以做氨气还原氧化铜的实验,其产物对空气无污染,对应的化学反应方程式为
查看习题详情和答案>>
(1)在图中,试管M中的液体应选用
稀硫酸或稀盐酸
稀硫酸或稀盐酸
.(2)在图中的虚线框中应连入的最合适的装置是图乙所示仪器中的
E
E
.
(3)上述制氢气的方法与将锌直接加入试管中相比,其优点有
由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止
由于铜与锌构成原电池,故生成氢气的速度快;可通过铜质燃烧匙的上下移动来直接控制反应的进行或停止
.(4)实验过程中,在试管M中可观察到的现象是
锌粒溶解,生成氢气,且氢气在铜质燃烧匙上产生
锌粒溶解,生成氢气,且氢气在铜质燃烧匙上产生
.(5)用上面的装置也可以做氨气还原氧化铜的实验,其产物对空气无污染,对应的化学反应方程式为
2NH3+3CuO═3Cu+N2+3H2O
2NH3+3CuO═3Cu+N2+3H2O
.在这个实验中,试管M中的液体应选用浓氨水
浓氨水
,小匙上的固体应该选用碱石灰
碱石灰
.科学解释能力是科学素养的重要组成部分.下列对实验现象及操作、物质的用途解释合理的是( )
|
查看习题详情和答案>>
某学习小组按如图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出).
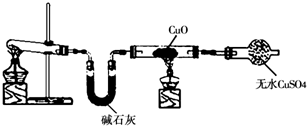
请回答:
(1)制取氨气的化学方程式是
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
①实验Ⅰ、Ⅱ、Ⅲ的目的是
②实验Ⅳ中反应的本质是(用离子方程式表示)
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
查看习题详情和答案>>

请回答:
(1)制取氨气的化学方程式是
Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑
| ||
Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑
.
| ||
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色; 同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
3CuO+2NH3
3Cu+N2+3H2O
| ||
3CuO+2NH3
3Cu+N2+3H2O
.②碱石灰的作用是
| ||
吸收氨气中混有的水蒸气,防止干扰产物的鉴定
吸收氨气中混有的水蒸气,防止干扰产物的鉴定
.(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解
.②实验Ⅳ中反应的本质是(用离子方程式表示)
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
.③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是
Cu+2H++H2O2=Cu2++2H2O
Cu+2H++H2O2=Cu2++2H2O
.