摘要: 使0.1mol/L K2CO3溶液中[K+]==2[].应采取的措施是 A.加少量盐酸 B.加适量KOH C.加适量水 D.加适量NaOH
网址:http://m.1010jiajiao.com/timu3_id_57397[举报]
(2009?清远模拟)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高.DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入.
(1)某学习小组利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用.
②用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器.
③由计算机绘制的滴定曲线如图一:
两曲线图起点不同的原因是
(2)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用
②醋酸与NaOH溶液反应的离子方程式为
③图中b点时,溶液中各离子浓度大小的关系是
④若图中某一点pH等于8,则c(Na+)-c(CH3COO-)的精确值为
查看习题详情和答案>>

(1)某学习小组利用DIS系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000mol/L的NaOH、HCl、CH3COOH溶液备用.
②用0.1000mol/L的NaOH溶液分别滴定10.00mL0.1000mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器.
③由计算机绘制的滴定曲线如图一:
两曲线图起点不同的原因是
CH3COOH不完全电离,HCl完全电离,使0.1mol/L的CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,pH大
CH3COOH不完全电离,HCl完全电离,使0.1mol/L的CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,pH大
;两曲线图中V1>
>
V2 (填“>”、“=”或“<”)(2)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用
酸式滴定管
酸式滴定管
(填仪器名称)量取20.00mL醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好DIS系统.如果锥形瓶中含有少蒸馏水,是否会影响测量结果否
否
(填“是”、“否”、“不能确定”).向锥形瓶中滴加0.1000mol/L的NaOH溶液,计算机屏幕上显示出溶液导电能力与加入NaOH溶液体积关系的曲线图(见图二).②醋酸与NaOH溶液反应的离子方程式为
CH3COOH+OH-=CH3COO-+H2O
CH3COOH+OH-=CH3COO-+H2O
.③图中b点时,溶液中各离子浓度大小的关系是
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
.④若图中某一点pH等于8,则c(Na+)-c(CH3COO-)的精确值为
9.9×10-7
9.9×10-7
mol/L.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)②、⑧、⑦的最高价含氧酸的酸性由强到弱的顺序是
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: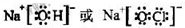
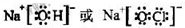 .
.
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
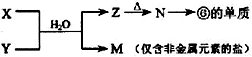
①X溶液与Y溶液反应的离子方程式为
③常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
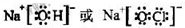
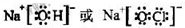
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
ab
ab
.a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
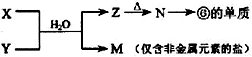
①X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
,②N→⑥的单质的化学方程式为2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
.
| ||
| 冰晶石 |
③常温下,为使0.1mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
溶液的pH等于7
溶液的pH等于7
.(2012?崇明县二模)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 .
.
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
A.MnO2 B.Na2SO4 C.Na2SO3 D.CaCO3
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
常温下,为使0.1mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH=
查看习题详情和答案>>
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
Na>Al>O
Na>Al>O
(填元素符号).②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
HClO4>H3PO4>H2CO3
HClO4>H3PO4>H2CO3
(填化学式).(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:


(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
A
A
.A.MnO2 B.Na2SO4 C.Na2SO3 D.CaCO3
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;常温下,为使0.1mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH=
7
7
.