网址:http://m.1010jiajiao.com/timu3_id_57248[举报]
(1)已知: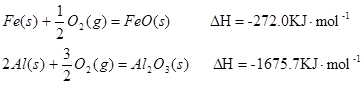
Al和FeO发生铝热反应的热化学方程式是 。(3分)
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。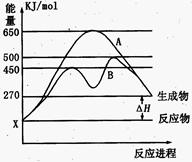
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应: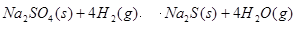 该反应的平衡常数表达式为 。
该反应的平衡常数表达式为 。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”)。
(1)已知:
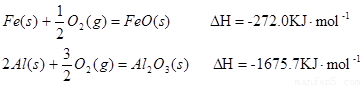
Al和FeO发生铝热反应的热化学方程式是 。(3分)
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:
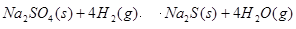 该反应的平衡常数表达式为 。
该反应的平衡常数表达式为 。
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”)。
查看习题详情和答案>>

Al和FeO发生铝热反应的热化学方程式是 。(3分)
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:
 该反应的平衡常数表达式为 。
该反应的平衡常数表达式为 。(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”)。
 △H=-272.0KJ?mo1-1
△H=-272.0KJ?mo1-1 △H=-1675.7KJ?mo1-1
△H=-1675.7KJ?mo1-1Al和Fe0发生铝热反应的热化学方程式是______.
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是______(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率______(填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为______.(选填序号).
A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(S)+4H2(g)═Na2S(s)+4H2O(g)
该反应的平衡常数表达式为______;
已知K1000℃<K1200℃,若降低体系温度,混合气体的平均相对分子质量将______(填“增大”、“减小”或“不变”).
(4)常温下;如果取0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8.
①混合液中由水电离出的OH-浓度与0.1mol?L-1 NaOH溶液中由水电离出的OH-浓度之比为______;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“<”、“>”或“=“);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
 查看习题详情和答案>>
查看习题详情和答案>>
| 1 |
| 2 |
2Al(s)+
| 3 |
| 2 |
Al和FeO发生铝热反应的热化学方程式是

(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是
②其中B历程表明此反应采用的条件为
A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(S)+4H2(g)═Na2S(s)+4H2O(g)
该反应的平衡常数表达式为
| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
已知K1000℃<K1200℃,若降低体系温度,混合气体的平均相对分子质量将
(4)常温下;如果取0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8.
①混合液中由水电离出的OH-浓度与0.1mol?L-1 NaOH溶液中由水电离出的OH-浓度之比为
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.