摘要:6.20℃时.向5瓶盛有90g水的容器中分别通入或加入下列物质各10g:①NaCl.②NH3.③Na2O2.④SO3.⑤CaO.得到5种溶液.它们的溶质质量分数大小比较是 ( ) A.都一样大 B.只有①和②相等 C.⑤=④>③>②>① D. ④>③>①=②>⑤
网址:http://m.1010jiajiao.com/timu3_id_56893[举报]
 (2012?东城区一模)某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图.某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)( ) (2012?东城区一模)某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图.某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)( )
|
查看习题详情和答案>>
某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图.某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)( )

A.A
B.B
C.C
D.D
查看习题详情和答案>>
| 选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
| A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
| B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
| C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
| D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |

A.A
B.B
C.C
D.D
查看习题详情和答案>>
 某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图.某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图.某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
| 选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
| A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
| B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
| C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
| D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
- A.A
- B.B
- C.C
- D.D
(Ⅰ)甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题: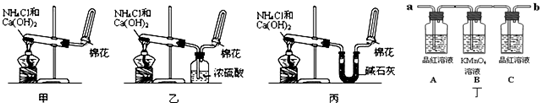
(1)甲、乙、丙三位同学制取氨气的化学方程式为: .
(2)他们都用向下排空气法收集氨气,其原因是 .
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是 (填“甲”、“乙”或“丙”).
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论): .
(5)三位同学都认为自己的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的是 (填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替? (填“能”或“不能”).
(Ⅱ)已知二氧化硫可使高锰酸钾溶液褪色.反应的化学方程式为:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
如图丁为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置.
(1)实验时,从 端连接盛有澄清石灰水的实验装置(用a或b填空).
(2)可观察到A瓶的溶液 .
(3)C瓶溶液的作用是 .
查看习题详情和答案>>

(1)甲、乙、丙三位同学制取氨气的化学方程式为:
(2)他们都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):
(5)三位同学都认为自己的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的是
(Ⅱ)已知二氧化硫可使高锰酸钾溶液褪色.反应的化学方程式为:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
如图丁为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置.
(1)实验时,从
(2)可观察到A瓶的溶液
(3)C瓶溶液的作用是
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.( 1 )装置中有刻度的甲管可以用
碱式滴定管
碱式滴定管
代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同.装置如图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
①每次实验至少需要用电子天平(能称准1mg) 称取镁粉
0.048
0.048
g;②冷却到25℃后,在读取气体体积时,首先应如何操作:
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
;③分析实验数据,t(a1)远远大于t(b1)的原因是
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
.(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol?L-1 NaOH溶液反应.回答下列问题:(已知锌的密度为 ρ g/cm3)
①写出Zn镀层与NaOH溶液反应的离子方程式
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入
分液漏斗
分液漏斗
(填仪器名称)实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol?L-1).则镀锌铁皮的锌镀层厚度为
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |