摘要:9.(1)2KCl O3+6NaHSO3==3Na2SO4+2KCl+3H2SO4.溶液中c(H+)增大.化学反应速率加快. (2)随着反应的进行.H2SO4和NaHSO3之间反应使H+及HSO3-浓度减小.后期化学反应速率减慢.
网址:http://m.1010jiajiao.com/timu3_id_56134[举报]
下列各反应中,氧化反应与还原反应在同种元素中进行的是( )
A、2KMnO4
| ||||
B、2KClO3
| ||||
| C、O3+2KI+H2O=2KOH+I2+O2 | ||||
| D、Cl2+2NaOH=NaCl+NaClO+H2O |
实验室可用MnO2和KClO3混合加热的方法制取氧气:
2KClO3
3O2↑+2KCl.
现有下列仪器或装置:
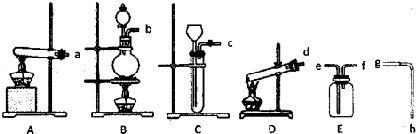
(1)A-D装置中,用作KClO3为原料制氧气的反应装置是 (填序号).
(2)排水法收集氧气,接口顺序是:氧气出口→ → →g→h→烧杯(填序号).
Ⅱ. KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入下图装置进行实验:
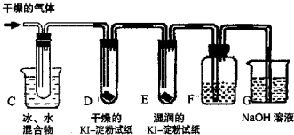
(3)若要确认副产物中含Cl2,F中应盛放 溶液.
(4)确定副产物中含有ClO2的现象是 .
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有O3的结论?
答: (填“能”或“不能”).理由是 .
Ⅲ.ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-.为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2.
(6)饮用水中c(ClO2-)= mol?L-1(用含字母的代数式表示).
查看习题详情和答案>>
2KClO3
| ||
| △ |
现有下列仪器或装置:

(1)A-D装置中,用作KClO3为原料制氧气的反应装置是
(2)排水法收集氧气,接口顺序是:氧气出口→
Ⅱ. KClO3分解时尚有副反应,导致收集到的气体有异味.据推测,副产物可能是O3、Cl2、ClO2中的一种或几种.资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2.为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入下图装置进行实验:

(3)若要确认副产物中含Cl2,F中应盛放
(4)确定副产物中含有ClO2的现象是
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有O3的结论?
答:
Ⅲ.ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-.为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I-═I2+2ClO2-,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I-═2I2+Cl-+2H2O,反应结束后叉产生b mol I2.
(6)饮用水中c(ClO2-)=
钴(Co)的氧化物是一种重要的化工原料,工业上利用CoCO3+O2→CoxOy+CO2反应来生产相应的钴的氧化物.实验室中可以用下列装置来制取钴的氧化物并测定其分子组成.

请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式
(2)E装置的U形管里盛放的物质是
A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强.已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCl溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为
(6)此实验装置存在一个比较大的缺陷,如何完善
查看习题详情和答案>>

请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;
| ||
| △ |
(2)E装置的U形管里盛放的物质是
C
C
;A.P2O5 B.无水CaCl2 C.碱石灰 D.无水CuSO4
(3)O3的氧化性比O2强.已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是
AD
AD
A.NaOH溶液 B.饱和NaHCO3溶液 C.饱和NaCl溶液 D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起
倒吸
倒吸
;(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为
Co2O3
Co2O3
;(6)此实验装置存在一个比较大的缺陷,如何完善
应在a处接一装有碱石灰的干燥管
应在a处接一装有碱石灰的干燥管
.下列表示反应中电子转移的方向和数目正确的是
A.MnO2+4HClM失去2e-nCl2+C得到2e-l2↑+2H2O
B.3S+6KOH===K2S失去4e-O3+2K2S得到2e-×2+3H2O
C.KClO3+6HCl===KCl得到6e-+3C失去6e-l2↑+3H2O
D.2KClO12e-3MnO2△2KCl+3O2↑
查看习题详情和答案>>(1)相同质量的臭氧(O3)和氧气(O2)所含的分子数之比是__________,所含原子数目之比是__________,在标准状况下所占的气体体积比是____________。
(2)在2KMnO4 + 16HCl=2KCl +2MnCl2 + 5Cl2↑+ 8H2O反应中,若被氧化的HCl是0.4mol,则反应生成_________克氯气,转移的电子数是_______________个。
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式并用双线桥标出电子转移情况 。
②漂白粉的有效成分是(填化学式) 。
查看习题详情和答案>>